Introduction
Même chez l’animal castré, il existe peu de distinction entre le comportement sexuel et le comportement social chez le lapin (Harriman 1995). La territorialité, les comportements de parade amoureuse comme les vocalises et les marches en cercle, et le comportement de nidification sont intimement liés à une volonté à se reproduire.
Il y a du vrai dans l’expression « to breed like rabbits »
La nature prolifique du lapin a fait de cet animal un modèle de fertilité et de cycle de la vie depuis l’Antiquité. En fait, le lapin de Pâques est probablement né de la croyance médiévale que les lapins, en tant que créateur de la vie, a fait naître l’aube (figure 1) (Mayer, 2003).

Figure 1. Les lapins ont été associés à la fertilité et au cycle de vie depuis l’Antiquité.
Crédit photo: Elliott Brown via Flickr Creative Commons Cliquez sur l’image pour l’agrandir.
Une lapine peut potentiellement avoir jusqu’à 60 jeunes par an. En raison de cette grande fécondité, les premiers explorateurs amenèrent des lapins comme source de nourriture et les libérèrent sur des îles éloignées. Malheureusement, l’absence de prédateurs a conduit à ces populations de lapins à devenir rapidement des nuisibles dans certaines îles comme la Nouvelle-Zélande (O’Malley 2005).
Le lapin mâle reproducteur
La tête et le corps d’un lapin mâle entier sont généralement plus trapus qu’une femelle entière (Richardson 2000). Le fourreau du pénis est de forme cylindrique et le pénis peut être facilement extériorisé chez les lapins après 2 mois. Les sacs scrotaux se situent cranio-latéralement au pénis. Le scrotum est oblongue et partiellement glabre. Les testicules sont de grande taille et comporte d’importants coussinets adipeux de l’épididyme (O’Malley 2005).
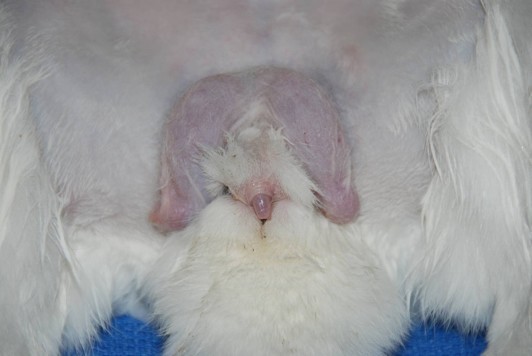
Figure 2. The oblong, partially hairless scrotal sacs sit craniolateral to the cylindrical penis. Crédit photo: Dr. Matt Rosenbaum. Cliquez sur l’image pour l’agrandir.
Les testicules descendent entre 10 à 14 semaines d’âge. La première descente testiculaire peut varier avec l’individu, la race, la température et l’environnement. Le lapin adulte peut rétracter ses testicules en les remontant dans l’abdomen à travers l’anneau inguinal ouvert lorsqu’il est stressé ou pour réguler la température testiculaire. Les testicules descendent lors des journées chaudes et sont ramenés près du corps durant les journées plus fraîches. Ce phénomène est différent d’un mâle cryptorchide par l’absence du sac scrotal (s) (O’Malley 2005, Richardson 2000).
Avant la castration d’un lapin mâle, l’élévation de l’arrière-train ou une légère pression sur l’abdomen caudal fera descendre les testicules dans le scrotum. Une technique de castration fermée est préférable pour réduire au minimum le risque d’une hernie inguinale postopératoire. Si une technique chirurgicale ouverte est effectuée, l’anneau inguinal superficiel doit être fermé.
La lapine femelle reproductrice
Les femelles adultes, en particulier de grande et de moyenne race, développent souvent un fanon ou un pli de peau sous le menton. Les femelles âgées ont tendance à être plus grandes que les mâles de la même race (Richardson, 2000).
Les ovaires sont allongés et sont situés relativement caudalement chez le lapin. Les trompes de Fallope sont très longues et enroulées. L’utérus duplex se compose de deux cornes utérines distinctes séparées sur toute leur longueur. Il n’y a pas de corps utérin. Le mésomètre est un site de stockage des graisses significative chez le lapin, proportionnellement beaucoup plus grand que chez d’autres animaux de compagnie. Les deux cornes utérines communiquent avec deux cols, qui se rejoignent pour former un vagin (O’Malley 2005). Le vagin de lapin est relativement long et sacculaire (Vella 2012). L’urètre pénètre dans la paroi dorsale du vagin; le clitoris se trouve sur la face ventrale. La vulve apparaît triangulaire avec une ouverture en forme de fente, et l’apparition de cette fente est utilisée pour distinguer les jeunes femelles des lapins mâles juvéniles.
Si la vessie est palpée alors que le lapin est en décubitus dorsal, le vagin relativement flasque peut potentiellement se remplir d’urine. Pour minimiser le risque de contamination pendant l’ovariohystérectomie, la vessie doit vidée par taxis externe après que l’induction du patient, avant que l’animal soit placé sur le dos (Jenkins 2012). Les ligaments suspenseurs sont relativement longs, ce qui rend l’extériorisation de l’utérus relativement facile. Cependant, la grande quantité de graisse dans le ligament large peut rendre difficile les ovariohystérectomies, même chez les jeunes femelles. Les doubles cols ne sont pas systématiquement supprimés lors d’une ovariohystérectomie. Cependant, leur retrait est conseillé pour les patients atteints de cervicite, de néoplasie, ou d’endométriose (Jenkins 2012, O’Malley 2005).
Le lapin femelle est un animal à ovulation induite. Bien que la femelle ne montre pas un cycle oestral régulier, si l’accouplement ne se produit pas, sa réceptivité sexuelle dépend de la régression des follicules ovariens et de l’apparition de nouveaux follicules matures. Les périodes de réceptivité sexuelle durent de 5 à 14 jours et sont suivis par un à deux jours pendant lesquel la femelle refusera de s’accoupler. Ce cycle se répète jusqu’à ce que une saillie se produise, bien que l’activité de l’ovaire diminue à mesure que la photopériode diminue au cours de la fin de l’été au mois d’hiver (2012 Vella, Klaphake 2012, O’Malley 2005).
La cytologie sur frottis vaginal ne peut pas être utilisée pour l’identification des différents stades du cycle sexuel de la femelle (O’Malley 2005), mais l’apparence de la vulve peut fournir un indice utile. Lorsque la femelle est réceptive, la vulve est plus gonflée et est souvent d’une couleur rose-violette ou rouge pourpre (Klaphake 2012, O’Malley 2005). Pendant l’ anoestrus, la vulve apparaît étroite et pâle (O’Malley 2005).
La femelle est amenée au mâle lors de la saillie
Les lapins mâle et femelle peuvent être très territoriaux. Afin de garantir un accouplement réussi, la femelle doit être introduite dans l’enceinte du mâle ou le couple placée en territoire neutre (Bays 2006, Richardson 2000).
Lors de l’accouplement, le mâle tourne autour de la femelle en reniflant et la léchant pendant environ 30 secondes (Vella 2012, Bays 2006). Il peut aussi uriner sur la femelle (Bays 2006). La femelle réceptive fait des bonds ou s’aplatit sur le sol (Bays 2006). Une lordose est observée lorsqu’on exerce une pression sur le dos (Bays 2006), tandis que la femelle non réceptive va fuir le mâle, et si elle se sent acculée elle peut vocaliser ou même mordre. L’accouplement actif commence quand le mâle saisit la femelle par la nuque avec ses dents. Il monte alors la femelle, la maintenant vigoureusement jusqu’à l’éjaculation qui se produit rapidement. Ensuite, le mâle émet un cri ou grince des dents, avant de tomber sur le dos ou sur le côté tandis que la femelle s’enfuit ou commence à mordre et à frapper le mâle (vidéo 1) (Bays 2006, Richardson, 2000).
Video 1. L’accouplement chez le lapin est très rapide.
L’ovulation se produit 10 à 13 heures après l’accouplement (Vella 2012, O ‘Malley 2005, Richardson 2000). Bien qu’un seul accouplement soit souvent suffisant pour stimuler l’ovulation, les éleveurs permettent aux deux partenaires de s’accoupler plusieurs fois sur une période de 30 minutes avant de remettre la femelle dans son enclos. Malgré sa grande fécondité, la femelle ne devrait pas avoir plus de trois portées en un an (Richardson, 2000). La reproductivité varie avec la race, avec les mâles qui reproduiront pendant 5-6 ans et les femelles pendant environ 3 ans (3012) Vella.
Les lapins ont une période de gestation courte
Par rapport aux lièvres avec une gestation de 40 à 50 jours, les lapins ont une période de gestation relativement courte de 31 jours en moyenne. La gestation peut varier de 28 à 35 jours (Vella 2012, Bays 2006, O’Malley 2005). Le risque d’augmentation de mortinatalité augmente à partir du jour 32 (O’Malley 2005). La taille de la portée varie de 4 à 12 jeunes (Vella 2012, Bays 2006). Les Lapins de petites races ont tendance à produire des portées plus petites qui sont naissent après une période de gestation relativement longue (Vella 2012). Les grandes portées sont naissent généralement après une période de gestation plus courte (O’Malley 2005). Le fœtus est palpable du jour 12 au jour 14 (Richardson 2000).
En dépit de leurs taux de fécondité élevés, les lapins ont tendance à souffrir d’une forte incidence de la mortalité embryonnaire. Il y a plusieurs raisons possibles à ce problème, comme les infections, l’hérédité, les traumatismes, l’utilisation de médicaments, la mauvaise alimentation, ainsi que le stress social ou environnemental. La mort et la résorption fœtales sont plus susceptibles de se produire chez une femelle dominée (Vella 2012, Klaphake 2012). Le risque est accru pour le fœtus au jour 13 de la gestation lorsque s’opérent des changements de placentation (hemochoriale), mais également au jour 21 associé à une réduction temporaire du débit sanguin, lors du changement de forme et de taille du foetus (Klaphake 2012, O’Malley 2005).
La parturition chez le lapin
La femelle commence à construire un nid plusieurs jours à quelques heures avant la parturition. La perte de poils est facilitée par les niveaux d’oestrogène et de progestérone qui chutent. La femelle s’arrache les poils de son abdomen, des flancs et de son fanon. Elle utilise ensuite la fourrure, du foin et de la paille pour construire son nid (figure 2) (Vella 2012, O’Malley 2005).

Figure 3. La biche entremêle les poils arrachés avec du foin et de la paille pour créer son nid. Crédit photo: André Mouraux via Flickr Creative Commons. Cliquez sur l’image pour l’agrandir.
Les lapereaux dans le nid
Contrairement aux jeune lièvres, les lapereaux nidicoles pèsent normalement de 40 à 50 grammes à la naissance (O’Malley 2005, Harkness 1995). Le lapereau naît glabre, avec des paupières et des canaux auriculaires fermés. La stimulation ano-génitale est nécessaire pour l’élimination des déjections (tableau 1) (Bays 2006).
| Tableau 1. Les stades de développement du lapin (Oryctolagus cuniculus) (Bautista 2013, Bays 2006, Richardson, 2000) | |
|---|---|
| Jour | <Stade du développement/td> |
| 7 | Début de la pousse de la fourrure |
| 10 | Ouverture des yeux |
| 12 | Ouverture des oreilles |
Malgré leur vulnérabilité, les jeunes ne sont pas couvés par la mère (Bautista 2013, Bays 2006). Leur taux de graisse brune sont plus élevés au cours des 2 premières semaines de vie. La graisse brune produit de la chaleur ou permet thermogenèse en raison de son vaste réseau capillaire et ses réserves ne sont pas affectés par l’état nutritionnel de l’animal (O’Malley 2005).
Jusqu’au jour 10 où la fourrure commence à se développer, les petits dépendent également fortement de la chaleur et de l’isolation fournie par les autres lapereaux de la portée (Bautista 2013, Bays 2006, Hull 1982). Les positions centrales dans la litière sont associées à une température corporelle plus élevée, une plus grande consommation de lait, un poids du corps plus important, et des taux de croissance plus rapides (Bautista 2013). Des différences de comportement ont également été identifiées sur la base de la position au sein du nid au cours de la première semaine de vie. Les animaux adultes qui occupent la périphérie du nid ont montré une “amélioration de l’instinct de survie”, étant « plus proactifs» que les lapereaux intermédiaires ou centraux de la nichée (Reyes Meza-2011).
Les lapereaux comptent beaucoup sur leur sens de l’odorat à la naissance. La mère est reconnue par l’odeur de ses excréments et la têtée est stimulée par une phéromone sécrétée par une glande près du mamelon (Vella 2012, O’Malley 2005). Est-ce que la mère peut ainsi marquer ses petits ? Cela explique-t-il que certaines femelles tuent des lapereaux d’autres portées? L’adoption réussie d’un lapereau exige de camoufler son odeur en le frottant dans le nid ou de placer le pus bas dans le nid (Baies 2006).
Le lait de lapin est extrêmement riche
Les lapines possèdent généralement huit glandes mammaires qui s’étendent de la région thoracique à la région inguinale. Seule la femelle a des mamellons. Elle peut posséder jusqu’à 10 mamelons, et la présence de mamelons accessoire est appréciée par les éleveurs de lapins (Vella 2012, O’Malley 2005).
Le lait de lapine est très riche, si riche que la femelle n’a besoin d’allaiter ses petits qu’une fois ou deux fois par jour (O’Malley 2005, Cheeke 1987). Le lait de lapin est très riche en matières grasses (9%) avec des niveaux exceptionnellement bas de lactose (1%) et il est très riche en protéines (13%) (tableau 2) (O’Malley 2005, Cheeke 1987, la FAO). Physiologiquement, l’allaitement est un moment très exigeant pour la mère. La consommation d’eau et la consommation de caecotrophes augmentent d’un facteur 10 pendant l’allaitement (O’Malley 2005).
| Lapin | Vache | |
| Lactose (%) | 1 | 5,0 |
| Protéines (%) | 13 | 3,3 |
| Matières grasses (%) | 9 | 3,0-4,0 |
La femelle consacre environ 3-5 minutes à allaiter son jeune (O’Malley 2005, Cheeke 1987). Les femelles en liberté recouvre le terrier avec de la terre chaque fois qu’elle le quitte (Bays 2006). Cette couverture permet de protéger le nid des prédateurs (Thompson, 1994).
L’estomac de lapin nouveau-né a un pH d’environ 5,0 à 6,5. Un estomac à ce pH, rempli de lait caillé, devrait normalement constituer un substrat idéal pour la prolifération bactérienne. Heureusement, l’estomac du lapereau contient un facteur de protection antimicrobien appelé « huile laitière» pendant les 3 premières semaines de vie. L’huile laitière est un mélange d’acides gras octanoïque et décanoïque et est produite par une réaction enzymatique qui se produit lorsque le lait entre en contact avec les enzymes dans le tube digestif du lapereau. Les lapins élevés à la main ne disposent pas de ce facteur de protection antimicrobien ce qui les rend vulnérables à l’infection (O’Malley 2005, Harkness 1995).
Les lapins sevrés sont susceptibles de développer des pathologies.
Les lapereaux commencent à quitter le nid et à manger des aliments solides à environ 18 à 21 jours. Le sevrage est généralement réalisé au jour 42. La mère se retire habituellement du nid pendant le processus de sevrage afin de permettre au jeune de rester dans une enceinte familière.
Le sevrage est un moment critique dans la vie du lapin car les jeunes sont vulnérables aux maladies. Les lapereaux commencent à manger les caecotrophes produites par leur mère à environ deux semaines d’âge. Au moment où l’effet protecteur de l’huile de lait se termine à 4 à 6 semaines, l’intestin n’a pas été complètement colonisé par des bactéries saines et pH de l’estomac n’a pas atteint son niveau de pH égal à 1-2. Des bactéries pathogènes, comme les coliformes et Clostridia spp., peuvent proliférer provoquant des entérotoxémies, favorisées par une alimentation faible en fibres et riches en glucides (O’Malley 2005, Cheeke 1987).
La puberté
Jusqu’à maturité sexuelle, des lapins sauvages vivent furtivement et souvent seul. A 3-4 mois, les jeunes peuvent former des couples et s’inscrire dans la hiérarchie sociale d’une colonie. Comme les mâles sont plus nombreux que les femelles, ils vivent parfois des vies solitaires, tels des individus « satellites » à la colonie (Thompson, 1994). Les taux de mortalité peuvent être aussi élevés jusqu’à atteindre 90% au cours de la première année de vie (Harriman 1995).
Le poids corporel est plus important que l’âge pour déterminer la maturité sexuelle. Le lapin juvénile atteint la puberté juste après connu son taux maximal de croissance; L’âge d’apparition de la maturité sexuelle varie avec la race du lapin. Les apins petites races se développent généralement plus vite et deviennent sexuellement matures à un âge plus précoce (tableau 3). Les femelles atteignent généralement la puberté avant les mâles (Vella 2012).
La production optimale de sperme se produit 40 à 70 jours après la puberté (Vella 2012). Les lapins mâles doivent être séparés des femelles à au moins 16 semaines d’âge pour prévenir des saillies non désirées.
Le comportement sexuel
Des comportements sexuels, tels que la territorialité et l’agression, sont plus intenses à l’adolescence. Les comportements observés incluent des frottements du menton sur les meubles, des courses en cercle, des vocalises tels que le « honk-honk » d’excitation sexuelle, des montes et un dos voussé. Pendant la puberté, les mâles et les femelles qui ont été préalablement élevés à utiliser une litière peuvent uriner et déféquer en dehors de leur cage pour marquer leur territoire (Bays 2012). Le comportement de nidification, comme creuser frénétiquement et mâcher, est communément observée chez les femelles (Bays 2012, 2006). Rendez-vous sur la page « Le comportement du lapin européen » pour des détails supplémentaires sur le comportement sexuel du lapin pubère.
Heureusement, la stérilisation modifie significativement le comportement du lapin de compagnie et es propriétaires avertis choisissent de stériliser leurs animaux. Des spermatozoïdes viables peuvent persister après la castration, il est donc prudent de séparer le mâle de la femelle pendant encore 4 à 6 semaines.
Pathologie
L’adénocarcinome utérin est la néoplasie la plus commune du lapin domestique (Varga 2013, Klaphake 2012, Vinci 2010, Walter 2010). L’incidence des tumeurs utérines est indépendante de l’historique reproductif des femelles (Klaphake 2012). L’âge est considéré comme le facteur de risque le plus important pour cette tumeur qui se développe lentement. L’incidence de la maladie est la plus élevée chez les lapins d’âge moyen et avancé (Klaphake 2012, Saito 2002). L’adénocarcinome utérin est présent chez environ 60% des femelles après 4 ans (Varga 2013); l’âge moyen des lapines atteintes est de 6,1 ans (Walter, 2010).
Les signes cliniques précoces de l’adénocarcinome utérin peuvent inclure des signes subtils, non spécifiques de la maladie tels que l’anorexie et la perte de poids, une infertilité, des pertes vaginales, et une hématurie (figure 3). Des muqueuses pâles peuvent être observées suite à une hémorragie sévère (Varga 2013, Walter 2010). Plus la maladie progresse, des symptômes supplémentaires incluent une stase gastro-intestinale, des glandes mammaires gonflées et douloureuses et un gonflement abdominal. Des masses multiples peuvent être palpées crânialement à la vessie lors de l’examen physique. Les femelles sont parfois présentées pour dyspnée secondaire à des métastases pulmonaires ou à une distension excessive de l’utérus (Varga 2013).

Figure 4. Hémomètre secondaire à un adénocarcinome chez une lapine. Notez l’utérus duplex. Crédit photo: Uwe Gille via Wikimedia Commons Cliquez sur l’image pour l’agrandir.
Les tumeurs utérines sont mieux gérées par la prévention. Les lapines non destinées à l’élevage doivent être stérilisées le plus tôt possible. Les propriétaires de femelles entières doivent être sensibilisés pour détecter les premiers signes de la maladie et de consulter régulièrement un vétérinaire pour un examen annuel de santé (Klaphake 2012).
Les autres pathologies fréquemment rapportées chez la lapine comprennent l’hyperplasie de l’endomètre, le pyomètre, l’endométrite et la pseudogestation (Varga 2013, Klaphake 2012, Walter 2010, O’Malley 2005). La pseudogestation, aussi connu comme “grossesse nerveuse”, peut se produire même dans une femelle vivant seule bien que les causes les plus courantes comprennent une accouplement stérile ou la présence d’un lapin mâle à proximité (Klaphake 2012, O’Malley 2005). Comme le corps jaune mature sécrète de la progestérone, l’élargissement de l’utérus et des glandes mammaires est plus prononcé au cours des 10 premiers jours. Au jour 16, les organes commencent à se développer. Le corps jaune commence à dégénérer après le 18ème jour. Comme les niveaux de progestérone chutent, la femelles s’arrachent de la fourrure pour faire un nid après les 18ème à 22ème jours (O’Malley 2005).
References
Références
Batista A, Castelán F, Pérez-Roldán H, et al. Competition in newborn rabbits for thermally advantageous positions in the litter huddle is associated with individual differences in brown fat metabolism. Physiol Behav 118:189-194, 2013.
Bays TB. Behavior of small mammals. . In: Quesenberry KE, Carpenter JW (eds). Ferrets, Rabbits, and Rodents: Clinical Medicine and Surgery (3rd ed). St. Louis: Elsevier Saunders; 2012: 545-549.
Bays TB. Rabbit behavior. In: Bays TB, Lightfoot TL, Mayer J (eds). Exotic Pet Behavior: Birds, Reptiles, and Small Mammals. St. Louis: WB Saunders; 2006: 1-17.
Cheeke PR. Rabbit Feeding and Nutrition. Orlando: Academic Press; 1987.
Coureaud G, Charra R, Datiche F, et al. A pheromone to behave, a pheromone to learn: the rabbit mammary pheromone. J Comp Physiol A Neuroethol Sens Neural Behav Physiol 196(10):779-790, 2010.
Food and Agriculture Organization of the United Nations (FAO). Milk composition. FAO website. Available at http://www.fao.org/agriculture/dairy-gateway/milk-and-milk-products/milk-composition/en/#.U3OSri_Q4bg. Accessed on May 14, 2014.
Harkness JE, Turner PV, Van de Woude S, Wheler CL (eds). Harkness and Wagner’s Biology and Medicine of Rabbits and Rodents, 5th ed. Baltimore: Wiley-Blackwell; 2010.
Harriman M. House Rabbit Handbook: How to Live with an Urban Rabbit, 3rd edition. Alameda: Drollery Press; 1995.
Hoffman KL, Rueda Morales RI, González-Mariscal G. Relevance of mating-associated stimuli, ovulation, and the progesterone receptor for the post-coital inhibition of estrous behavior in the female rabbit. Horm Behav 58(5):747-753, 2010.
Hull J, Hull D. Behavioral thermoregulation in newborn rabbits. J Comp Physiol Psychol 96(1):143-147, 1982.
Jenkins JR. Soft tissue surgery. In: Quesenberry KE, Carpenter JW (eds). Ferrets, Rabbits, and Rodents: Clinical Medicine and Surgery (3rd ed). St. Louis: Elsevier Saunders; 2012: 271-273.
Klaphake E, Paul-Murphy J. Disorders of the reproductive and urinary systems. In: Quesenberry KE, Carpenter JW (eds). Ferrets, Rabbits, and Rodents: Clinical Medicine and Surgery (3rd ed). St. Louis: WB Saunders; 2006: 217-218.
Levy F, Keller M, Poindron P. Olfactory regulation of maternal behavior in mammals. Horm Behav 46(3):284-302, 2004.
Mayer J. Natural history of the rabbit (Oryctolagus cuniculus). Exotic Mammal Medicine and Surgery 1(1)6, 2003.
O’Malley B. Clinical Anatomy and Physiology of Exotic Species. St. Louis: Elsevier Saunders; 2005.
Reyes-Meza V, Hudson R, Martinez-Gomez M, et al. Possible contribution of position in the litter huddle to long-term differences in behavioral style in the domestic rabbit. Physiol Behav 104(5):778-785, 2011.
Richardson VCG. Rabbits: Health, Husbandry and Diseases. Wiley-Blackwell Science; 2000.
Rödel HG, Starkloff A, Bruchner B, von Holst D. Social environment and reproduction in female European rabbits (Oryctolagus cuniculus): benefits of the presence of litter sisters. J Comp Psychol 122(1):73-83, 2008.
Saito K, Nakanishi M, Hasegawa A. Uterine disorders diagnosed by ventrotomy in 47 rabbits. J Vet Med Sci 64(6):495-497, 2002.
Thompson H, Carolyn King. The European Rabbit: The History and Biology of a Successful Colonizer. New York: Oxford University Press; 1994.
Varga M. Uterine disorders. In: Mayer J, Donnelly TM (eds). Clinical Veterinary Advisor: Birds and Exotic Pets. St. Louis, MO: Elsevier Saunders: Publisher; 2013. Pp. 424-426.
Vella D, Donnelly TM. Basic anatomy, physiology, and husbandry. In: Quesenberry KE, Carpenter JW (eds). Ferrets, Rabbits, and Rodents: Clinical Medicine and Surgery (3rd ed). St. Louis: Elsevier Saunders; 2012: 166-169.
Walter B, Poth T, Böhmer E, et al. Uterine disorders in 59 rabbits. Vet Rec 166(8):230-233, 2010.
Further reading
Kaufmann-Bart M, Fischer I. Choriocarcinoma with metastasis in a rabbit. Vet Pathol 45(1):77-79, 2008.
Kurotaki T, Kokoshima H, Kitamori F, et al. A case of adenocarcinoma of the endometrium extending into the leiomyoma of the uterus in a rabbit. J Vet Med Sci 69(9):981-984, 2007.
Vinci A, Bacci B, Benazzi C, et al. Progesterone receptor expression and proliferative activity in uterine tumours of pet rabbits. J Comp Pathol 142(4):323-327, 2010.