Puntos clave
- Las aves rapaces ingieren presas enteras. El material no digerible o “egagrópila”, como la piel, plumas y huesos, son retenidos dentro del ventrículo, son compactados en un gránulo y luego regurgitados.
- La egestión puede ocurrir tan rápido como 12-18 horas después de una comida. El ave no se debe alimentar de nuevo hasta que se haya producido una egagrópila.
- La emaciación es común en las aves rapaces jóvenes que no son buenas cazadoras durante su primer año. Las aves también pueden ser presentadas en malas condiciones debido a una variedad de causas, incluyendo las inclemencias del tiempo o una lesión crónica.
- La anemia e hipoproteinemia son hallazgos comunes en las aves de presa con malnutrición crónica.
- Mientras que la enfermedad crónica y el estrés a menudo conducen a un estado hipermetabólico, el metabolismo se retarda en el paciente desnutrido o hambriento.
- Cuando se comparan con los loros o las aves cantoras, las aves rapaces pueden sobrevivir a la escasez de alimentos durante períodos de tiempo más largos. Las aves rapaces más pequeñas son menos tolerantes a la inanición en comparación con las aves más grandes.
- La atención de apoyo para el ave rapaz con malnutrición crónica incluye la fluidoterapia y el calor suplementario. También es crítico reducir al mínimo el estrés para los pacientes débiles y demacrados.
- Siempre y cuando el paciente posea un tracto gastrointestinal funcional, la nutrición enteral puede ser iniciada una vez que el paciente se encuentre cálido y adecuadamente hidratado.
- Evite el material no digerible (que forma la egagrópila) si el ave se encuentra delgada, si se administra un medicamento varias veces al día o si el ave es muy joven (menos de 3 semanas de edad).
- Cuando su alimento preferido no está disponible, la mayoría de las aves rapaces comen cualquier fuente de carne apropiada, siempre y cuando este desprovista de piel. Sin embargo, las águilas pescadoras a menudo requieren de alimentación manual en cautiverio.
- Aunque es relativamente caro, comúnmente se alimentan con ratones y ratas a las aves de presa. Los ratones y ratas criadas en cautiverio tienden a ser relativamente altas en grasa.
- Los polluelos de un día de edad con el saco vitelino intacto, son una fuente adecuada de proteína y calcio y una buena fuente de vitaminas solubles en grasa.
- Las aves rapaces no se deben alimentar con palomas, ya que varios agentes infecciosos pueden ser transmitidos.
- El método más seguro y preferido para descongelar los alimentos potencialmente peligrosos, tales como los ratones congelados, es el uso de un refrigerador limpio designado para la descongelación de estos alimentos durante 24-48 horas.
- Supervise el paciente que está recibiendo el apoyo nutricional cuidadosamente, evalúe el peso corporal, el índice de condición corporal, los excrementos y la producción de egagrópilas.
- Las aves rapaces silvestres adquieren la mayor parte de sus necesidades de agua diaria a través de su dieta, sin embargo, las aves rapaces en cautiverio siempre deben tener acceso a agua potable fresca.
Introducción
Las aves rapaces o de presa son un grupo diverso que incluye a los búhos, halcones, águilas, gavilanes, milanos y buitres (Figura 1).

Figura 1. El grupo conocido como las aves rapaces o aves de presa son un grupo diverso. Créditos fotográficos: Dra. Elizabeth Daut (left), Beka Weiss via Flickr Creative Commons (FCC) (middle) y John Haslam vía FCC (right). Haga clic en la imagen para ampliar.
Todas las aves rapaces consumen una dieta a base de carne que varía desde la dieta especializada del águila pescadora (Pandion haliaetus) que se alimenta de peces, a una dieta generalista que puede incluir insectos, mamíferos, aves, reptiles, anfibios e incluso carroña. Aparte de las aves de corral, los requerimientos nutricionales exactos de las aves son desconocidos. Sin embargo, la dieta natural de las aves rapaces es siempre relativamente alta en proteínas y grasas y baja en carbohidratos. Las dietas de presa entera tienen una relación de calcio/fósforo de 1.5:1, ya que el ave consume tanto los huesos como la carne (Kubiak 2012, Bird, 1976).
Especializaciones gastrointestinales de las aves rapaces
El tracto gastrointestinal de las aves rapaces difiere sustancialmente del tracto gastrointestinal que se observa en las aves granívoras y omnívoras, como los loros y los pollos.
- La mayoría de las aves rapaces diurnas poseen un buche en forma de huso que está especialmente desarrollado en los buitres. Los búhos (Orden Strigiformes) carecen de buche, sin embargo, la comida puede ser almacenada a lo largo del esófago (Murray 2014, Klasing 1998, Duke 1997, McLelland 1979).
- El estómago se puede expandir para contener grandes presas con la ayuda de crestas de la mucosa en la superficie serosa del proventrículo. El ventrículo tiene una pared delgada y poco músculo, en comparación particularmente con las aves granívoras que utilizan el ventrículo para moler semillas y granos (Murray 2014, Denbow 2000, Duke 1997, McLelland 1979).
- El material no digerible, como la piel, las plumas y los huesos, son retenidos dentro del ventrículo, son compactados en un gránulo o egagrópila y luego es regurgitado (Figura 2) (Forbes 2015, Murray 2014, Duke 1997).
Evaluación del estado nutricional
Índice de condición corporal
El índice de condición corporal (ICC) refleja los cambios en la composición corporal y el estado nutricional mucho mejor que el peso corporal por sí mismo. La puntuación se basa en la palpación de la musculatura pectoral, la visualización de los depósitos de grasa subcutáneos y la palpación de la grasa celómica. La escala de ICC en las aves es clasificada de 1 (emaciación) a 5 (obesidad). El exceso de energía o la obesidad es más frecuente en las aves en cautiverio alojadas en aviarios de reproducción permanentes o en parques zoológicos (Forbes 2015, Chitty 2008). A pesar que la musculatura pectoral puede estar atrofiada por falta de uso debido a la temprana edad o a lesiones, el paciente demacrado típicamente pierde por lo menos un tercio del peso corporal normal y parece anormalmente delgado (Figura 3).
La emaciación es una presentación común en las aves rapaces que no han aprendido a cazar con éxito durante su primer año de vida. Las aves también pueden ser presentadas en mala condición debido a una variedad de causas tales como la incapacidad para cazar o comer alimentos, las inclemencias del tiempo, lesiones crónicas o cuando quedan atrapadas en un edificio o alguna otra estructura construida por el hombre (Murray 2014, Handrich 1993 García-Rodríguez 1987, Shapiro 1981). Los déficits de energía también pueden ser observados en las aves de cetrería como resultado de las prácticas de entrenamiento inadecuadas (Chitty 2008).

Figura 3. Emaciación (ICC 1) en un halcón de cola roja de un año de edad (Buteo jamaicensis). Foto proporcionada por la Dra. Elizabeth Daut. Haga clic en la imagen para ampliar .
Análisis de sangre
Retrase las pruebas diagnósticas hasta que el paciente se encuentre lo suficientemente estable como para manejar el estrés de la restricción y la venopunción. Las pruebas de laboratorio iniciales a menudo incluyen la hematología, la evaluación de un frotis de sangre en busca de parásitos, la medición de la proteína total, el hematocrito, la glucosa en sangre e idealmente la creatina quinasa, el lactato deshidrogenasa, el aspartato aminotransferasa y los electrolitos. La anemia e hipoproteinemia son hallazgos comunes en las aves de presa con malnutrición crónica (Figura 4) (Murray 2014, Redig 2009).
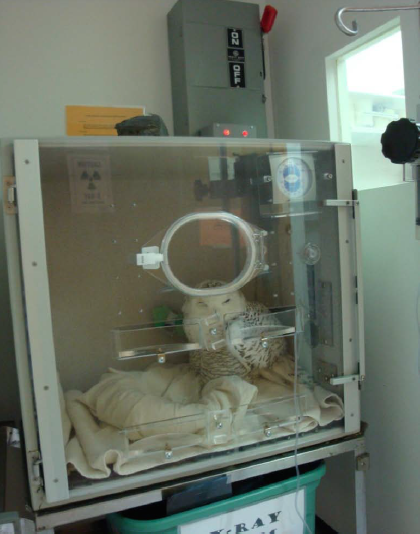
Figura 4. Búho nival o del ártico (Bubo scandiacus) rehabilitado en el Centro de Vida Silvestre de Virginia. Las pruebas diagnósticas iniciales revelaron una proteína total de 0.6 mg/dL, un hematocrito de 16% y una glucosa de 101 mg/dL. Foto proporcionada por la Dra. Elizabeth Daut. Haga clic en la imagen para ampliar .
Los niveles normales de glucosa en la sangre pueden ser muy variables en las aves rapaces. Los niveles suelen superar los 150 mg/dL (8.33 mmol/L) en las aves sanas y pueden ser tan altos como los 800 mg/dL (44.44 mmol/L) en algunas especies más pequeñas. La actividad convulsiva se puede observar si los niveles de glucosa caen por debajo de los 80 mg/dL (4.44 mmol/L). Afortunadamente la glucosa sanguínea tiende a mantenerse dentro de los límites normales por un período relativamente largo en las aves rapaces en ayunas (O’Donnell 1978).
Pruebas complementarias
Realice las pruebas de parásitos en heces (citología húmeda fresca/flotación), sobre todo en las aves delgadas. Administre un antihelmíntico según sea necesario (Murray 2014). La historia clínica y los hallazgos del examen físico también pueden indicar las pruebas diagnósticas adicionales que se deben obtener, como las radiografías y/o la endoscopia.
Necesidades metabólicas durante la inanición vs el estrés
Inanición
El hambre se asocia con una disminución gradual de la tasa metabólica, lo que resulta en hipometabolismo. Durante la inanición, el paciente intenta mantener niveles normales de glucosa en la sangre mediante el aumento de la gluconeogénesis y glucogenólisis, al tiempo que reduce las reservas de glucógeno. Cuando se agotan las reservas de glucógeno, el músculo y la grasa se descomponen para proveer sustrato para la gluconeogénesis. Finalmente, la inanición afecta la masa proteica visceral y la función de los órganos vitales (Parrish 2005).
Las reservas de glucógeno se agotan por lo general dentro de las 24 horas de ayuno en el ave granívora, sin embargo, proyectos de investigación han demostrado que las aves rapaces pueden ser relativamente tolerantes a la privación aguda de alimentos. A pesar de una pérdida promedio de masa corporal de 28% y 26% durante los días 8 y 13 de ayuno respectivamente, las lechuzas comunes (Tyto alba) y los ratoneros comunes (Buteo buteo) fueron capaces de volar y comer por sí mismas cuando el alimento fue introducido de nuevo (Handrich 1993, García-Rodríguez 1987). No se observaron cambios significativos en el hematocrito o la proteína total en los ratoneros en ayunas (García-Rodríguez 1987). Por el contrario, los cernícalos americanos (Falco sparverius) que fueron privados de alimentos durante 3 días, perdieron 17-20% de masa corporal y tanto el metabolismo como la temperatura corporal disminuyeron. Los investigadores concluyeron que los cernícalos habrían muerto si el ayuno se hubiese extendido por 5 días (Shapiro 1981).
Hipermetabolismo
Durante el estrés fisiológico, la fuente de energía preferida es la masa corporal magra, lo que resulta en un aumento del catabolismo de proteínas corporales. Los requerimientos de energía se incrementan en un 30-50% para sostener la reparación de tejidos, los procesos inflamatorios y la función inmune. La liberación de catecolaminas, glucagón y glucocorticoides aumenta la tasa de gluconeogénesis y glucogenólisis, aumentando aún más la tasa metabólica (Labato 1992). Muy poco se sabe sobre el estado hipermetabólico en las aves en general o en las aves rapaces en particular, pero estos mismos principios se cree que son aplicables.
Cuidados de apoyo
La atención de apoyo para el ave rapaz con malnutrición crónica o inanición debe incluir la fluidoterapia, el calor suplementario y medidas para minimizar el estrés. Además de las medidas estándar de reducción del estrés, cuando se hospitaliza a estas especies especiales*, las aves rapaces también pueden ser calmadas cubriendo ligeramente la cabeza con una toalla o una caperuza de cetrería (Figura 5).

Figura 5. Las caperuzas de cetrería se utilizan comúnmente para calmar a las aves de presa. Foto proporcionada por Andreas Praefcke vía Wikimedia Commons. Haga clic en la imagen para ampliar .
* Nota del editor: Vea el artículo Cuidado y Manejo Básico: Hospitalización de Mascotas No Tradicionales y Sala de Emergencias para Animales Exóticos: Cuidado Crítico para el Paciente Aviar para obtener información adicional.
Fluidos
La mayoría de los pacientes que son presentados a los centros de vida silvestre están deshidratados por lo menos un 5% y muchas aves rapaces delgadas o desnutridas tienen hasta un 12% de deshidratación. Normalice el estado de hidratación gradualmente en un período de 24-48 horas, aunque las pérdidas continuas necesitan ser reemplazadas con mayor rapidez. Visite el artículo Fluidoterapia en el Paciente Aviar para obtener información adicional.
Los fluidos subcutáneos son una vía eficaz de administración de fluidos para los pacientes con enfermedades leves. Coloque un catéter intravenoso o intraóseo en los pacientes más debilitados, pero tenga en cuenta el riesgo de sobrecarga de fluidos en el paciente con hipoproteinemia. Suplemente a los pacientes con tiamina y otras vitaminas B, antes y durante la re-alimentación inicial (tiamina 1-2 mg/kg SC cada 24 horas) (Murray 2014). Los fluidos de mantenimiento a menudo se continúan durante 3-5 días después del inicio de la alimentación. La transfusión sanguínea también es una opción para el paciente crítico con anemia grave e hipoproteinemia.
Calor suplementario
La hipotermia es muy común en las aves rapaces debilitadas y demacradas. Proporcione calor suplementario para evitar que el ave gaste energía en la termorregulación. Los fluidos tibios intraóseos o intravenosos y una unidad de cuidados intensivos con calefacción pueden elevar la temperatura corporal central y periférica.
Indicaciones para el soporte nutricional
Las indicaciones para el soporte nutricional van desde la pérdida de peso profunda y la anorexia hasta una enfermedad o lesión grave (Tabla 1).
Tabla 1. Indicaciones para el soporte nutricional
• 5-10% de pérdida de peso corporal
• Anorexia total o parcial por más de 3 días
• Trauma, cirugía, enfermedad sistémica
• Hipoproteinemia
Cálculo de las necesidades de energía
La tasa metabólica basal (TMB) representa la cantidad mínima de energía o kilocalorías (kcal) necesarias para mantener al cuerpo en reposo o la energía para mantenerse con vida. Una estimación de la TMB se basa en la medición por escala del metabolismo, donde TMB = K x (peso en kg elevado a la 0.75). El factor K es una constante teórica para las kilocalorías utilizadas en un período de 24 horas. El valor de K para las aves no paseriformes es de 78 (Murray 2014).
Los requerimientos de energía de mantenimiento (REM) son iguales a TMB más la energía necesaria para la actividad normal física, la digestión y la termorregulación. REM se calcula como 1.5 x TMB (Forbes 2015, Murray 2014, Kirkwood 1981). Las aves más grandes consumen más alimentos, pero la ingesta diaria de alimentos es equivalente a un porcentaje significativamente menor de su masa corporal (Forbes 2015).
Alimentación por sonda
Siempre y cuando el paciente posea un tracto gastrointestinal funcional, la nutrición enteral puede iniciarse una vez este se encuentre cálido y adecuadamente hidratado (Murray 2014). Los fluidos orales con electrolitos como el Pedialyte (Abbott) son a veces ofrecidos antes de la alimentación por sonda. Evite ofrecer soluciones ricas en glucosa ya que las dietas normales de las aves rapaces tienen poca glucosa y algunos proyectos de investigación indican que las soluciones de glucosa pueden acelerar la muerte en las aves rapaces debilitadas (Dobbs 1983). Ver el algoritmo compartido por el Dr. Scott Ford para obtener un resumen útil sobre el apoyo nutricional para las aves rapaces (Figura 6).

Figura 6. Algoritmo para la resucitación con fluidos y re-alimentación de las aves rapaces. Haga clic en la imagen para ampliar. Fuente: Dr. Scott Ford. Haga clic aquí para descargar la versión en PDF (112 KB)
*Nota del editor: La Unión Europea ha recomendado la prohibición del uso de Hetastarch (almidón hidroxietilo o HES) en pacientes humanos y la Administración de Alimentos y Drogas de los Estados Unidos ha instituido un “símbolo de advertencia”. Estos fluidos coloides han sido asociados con lesiones renales agudas y coagulopatías en algunos pacientes sépticos. Un estudio veterinario reciente también ha encontrado un aumento en el riesgo de resultados adversos incluyendo la muerte o lesiones renales agudas en perros que recibieron terapia con HES (Hayes 2016). Algunos veterinarios han eliminado por completo el uso de coloides en sus prácticas mientras que otros seleccionan HES de bajo peso molecular, como Voluven (Hospira) o Vetstarch (Abbott Labs).
La fórmulas que se utilizan para la alimentación por sonda en las aves rapaces incluyen la dieta de cuidados intensivos Emeraid Carnivore (Emeraid LLC) y las dietas de recuperación como Carnivore Care (Oxbow), a/d Canine/Feline Critical Care (Hill’s) y Maximum-Calorie (Iams). Divida las necesidades calóricas del paciente por el contenido de energía de la fórmula (calorías por ml) para determinar el volumen total de la fórmula que debe ser administrada por día. Poco a poco aumente la cantidad total alimentada diariamente durante al menos 2-3 días hasta que el paciente sea alimentado con los requerimientos de energía de mantenimiento (REM) (Recuadro 1). Los pacientes debilitados son típicamente alimentados con pequeños volúmenes de fórmula tres o cuatro veces al día (Murray 2014). En las aves de cetrería bien entrenadas, que no requieren de restricción, esto se puede lograr con el uso de un tubo de esofagostomía (Huynhet al 2014).
Recuadro 1. Fórmulas para la alimentación por sonda
Un halcón de cola roja (Buteo jamaicensis) de 900 gramos es presentado con una fractura de húmero derecho. ICC 2/5.
TMB = 78 (0.9)0.75 = 72 kcal/día
REM estimado: 1.5 x TMB = 108 kcal/día
Emeraid Carnivore = 1.67 kcal/ml
108 kcal/día ÷ 1.67 kcal/ml = 65 ml al día
Aunque el cálculo de las necesidades calóricas es crucial, la alimentación también debe tener en cuenta el volumen estimado del buche y el estómago. El volumen alimentado inicial no debe ser más de aproximadamente 1-1.5% del peso corporal, aumentando de 2-3% en la siguiente alimentación y el volumen alimentado no debe superar el 5% del peso corporal (Huynh et al 2014). Cuando se utiliza un tubo de esofagostomía, un volumen más pequeño que no exceda el 1.5%, se alimenta con una mayor frecuencia (N. Forbes, comunicación escrita, Sep 2015). Alimente la fórmula a través de un tubo de goma o de metal (Figura 7) (Recuadro 2).
Recuadro 2. Volumen del buche
El volumen total del buche en un halcón de 900 gramos se estima como el 5% del peso corporal en gramos o 50 ml/kg = 45 ml
La alimentación por sonda inicial es a menudo el 2.5-3% del peso corporal.
25 ml/kg = 22.5 ml
30 ml/kg = 27 ml
Por lo tanto, el volumen de la primera alimentación debe oscilar entre los 23 a 27 ml.
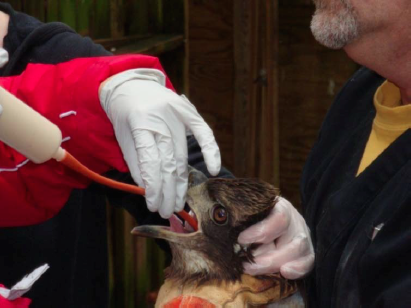
Figura 7. Alimentando a un halcón de cola roja (Buteo jamaicensis) con una sonda de goma roja. Foto proporcionada por la Dra. Elizabeth Daut. Haga clic en la imagen para ampliar .
Alimentación de presas
Al ser presentadas, algunas aves rapaces enfermas o heridas pueden alimentarse por sí mismas, aunque la alimentación no se debe comenzar hasta que el paciente se encuentre cálido y rehidratado. Las aves rapaces adultas son normalmente alimentadas una vez al día y las aves alimentadas con presas completas no deben ser re-alimentadas hasta que hayan regurgitado la egagrópila (Forbes 2015). Remueva la materia no digerible, como la piel y las plumas, si el ave se encuentra en malas condiciones o si se está administrando un medicamento varias veces al día (Forbes 2015).
Se puede realizar una transición de la alimentación por sonda a los alimentos sólidos, una vez que la hidratación y las anormalidades de los electrolitos se hayan resuelto, el paciente sea capaz de mantener su peso corporal y parezca entusiasmado por la comida. La comida inicial para estos pacientes a menudo consiste en tres o cuatro trozos pequeños de ratones u otra presa entera, desprovistos de pelo o plumas y remojadas en agua tibia. Si el paciente elimina heces normalmente (ver el seguimiento a continuación) y no se observan complicaciones, entonces la cantidad de comida que se ofrece se puede aumentar gradualmente. Ofrezca varias comidas pequeñas al día, para permitir el vacío del buche entre las comidas. A medida que el ave ha recuperado la condición normal del cuerpo, sigue demostrando un buen apetito y elimina heces normales, se puede introducir gradualmente el material indigerible (Murray 2014). Una vez que el paciente está estable, ofrezca la presa completa incluyendo los órganos internos, para asegurarse que la dieta sea nutricionalmente equilibrada (Figura 8) (Murray 2014, Klasing 1998). La presa debe ser del tamaño adecuado para que el ave la pueda consumir en su totalidad.

Figura 8. Al comienzo las presas enteras se ofrecen “picadas”. Foto proporcionada por la Dra. Elizabeth Daut. Haga clic en la imagen para ampliar .
Si el alimento no es consumido inmediatamente, no permita que permanezca dentro del encierro por largos períodos de tiempo ya que la proliferación de bacterias y la contaminación pueden ocurrir (Chitty 2008). Idealmente el alimento no debe permanecer en el encierro por más de 30-60 minutos (Chitty 2008), especialmente cuando el encierro se encuentra al aire libre durante los meses de calor. Si el ave no comienza a ingerir el alimento, continúe la alimentación por sonda y luego ofrezca otra vez alimentos sólidos al final del día o al día siguiente (Figura 9).

Figura 9. Alimentación asistida de pedazos de presa completa humedecidos a un halcón. Foto proporcionada por la Dra. Elizabeth Daut. Haga clic en la imagen para ampliar .
Alimentación de las aves en crecimiento
Al alimentar de forma asistida a las aves rapaces jóvenes, ofrezca pequeños trozos de comida lentamente usando tenazas o pinzas hemostáticas. Ligeramente humedezca los alimentos con agua tibia y monitoree cuidadosamente el vaciado del buche. Los buitres jóvenes pueden ser particularmente difíciles de criar y alimentar debido a su tendencia a regurgitar si están estresados. Chitty (2008) recomienda pre-digerir parcialmente los alimentos, cubriéndolos en un suplemento pancreático comercial durante 30 minutos.
Los polluelos jóvenes son incapaces de regurgitar el material no digerible o ‘egagrópila’ y se encuentran bajo riesgo de impactación proventricular o de muerte (Forbes 2015). No alimente material indigerible a cualquier polluelo de menos de 12 días de edad. Algunas especies como el halcón esmerejón (Falco columbarius) no deben ser alimentadas con material indigerible hasta aproximadamente los 20 días de edad (Forbes 2015). Mientras que las presas enteras tienen una relación de calcio/fósforo (Ca:P) equivalente a 1.5:1; la carne sin hueso tiene una relación Ca:P de 1:20 (Kubiak 2012, Bird 1976). Al igual que todos los animales en crecimiento, los polluelos tienen mayores requerimientos de calcio y vitamina D3 y si son alimentados con una dieta sin huesos o suplementos de vitaminas/minerales, el polluelo está en riesgo de desarrollar hiperparatiroidismo nutricional secundario (Figura 10 y 11) (Chitty 2008). La desviación de los huesos largos y múltiples fracturas plegables son hallazgos comunes en las aves rapaces alimentadas exclusivamente con dietas de carne sin huesos (Kubiak 2012).
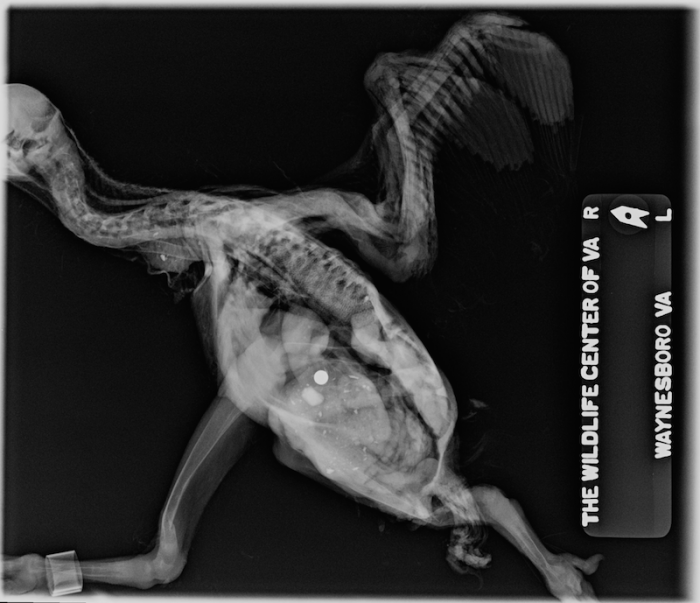
Figura 10. Proyección radiográfica lateral de un polluelo de buitre negro (Coragyps atratus) con hiperparatiroidismo nutricional secundario o enfermedad metabólica ósea. Foto proporcionada por el Dr. Dave McRuer, Centro de Vida Silvestre de Virginia. Haga clic en la imagen para ampliar .
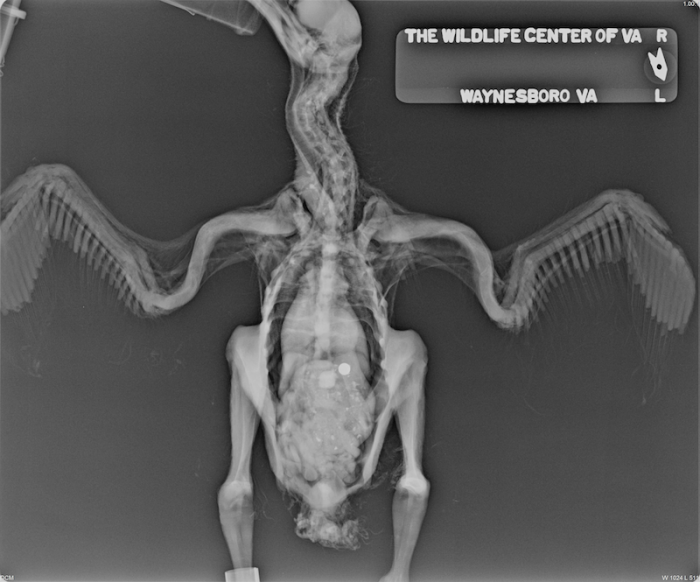
Figura 11. Proyección ventrodorsal de un polluelo de buitre negro (Coragyps atratus) con enfermedad metabólica ósea. Foto proporcionada por el Dr. Dave McRuer, Centro de Vida Silvestre de Virginia. Haga clic en la imagen para ampliar.
Opciones de presas completas para la alimentación de las aves rapaces
La mejor dieta para las aves rapaces en cautiverio es una que se parece lo más cerca posible a la dieta natural (Murray 2014, Chitty 2008, Cooper 2002). Afortunadamente la mayoría de las aves rapaces en un centro de rehabilitación consumen fácilmente cualquier fuente de carne apropiada cuando su alimento preferido no está disponible (Murray 2014, Chitty 2008). Sobre todo cuando el alimento se corta y abre o se le quita la piel. Las águilas pescadoras son una excepción notable y la alimentación asistida se requiere a menudo en cautiverio (Murray 2014).
La composición nutricional de los diferentes tipos de presa es generalmente completa y constante, aunque el contenido de grasa puede variar (Murray 2014, Klasing 1998).
Mamíferos
Los conejos y roedores son alimentados comúnmente a las aves rapaces en cautiverio que se alimentan de mamíferos. Aunque es relativamente caro, los ratones y ratas de laboratorio son alimentos populares. Las ratas y ratones criados en cautiverio tienden a ser más altos en grasa y bajos en proteínas que sus contrapartes silvestres (Figura 12) (Murray 2014, Chitty 2008, Crissey 1999, Douglas 1994). Para reducir al mínimo el riesgo de grasa excesiva en la dieta, ofrezca ratas y ratones sub-adultos que pesen aproximadamente 75% del peso adulto (N. Forbes, comunicación escrita, Septiembre 2015).

Figura 12. Los ratones son una fuente adecuada de nutrición que comúnmente se usan para alimentar a las aves rapaces en cautiverio. Sin embargo, los ratones de laboratorio tienden a ser relativamente altos en grasa. Foto proporcionada por la Dra. Elizabeth Daut. Haga clic en la imagen para ampliar .
Aves
Las aves rapaces en rehabilitación son normalmente alimentadas con polluelos de un día de edad, codornices del género Coturnix, gallinas y pavos (Forbes 2015, Murray 2014, Chitty 2008). Los polluelos se encuentran disponibles fácilmente y son relativamente baratos. Los polluelos de un día de edad de buena calidad contienen cantidades adecuadas de proteínas y buenos niveles de calcio y vitaminas solubles en grasa. Desafortunadamente los polluelos de un día de edad y otras dietas derivadas de aves conllevan a un mayor riesgo de transmisión de Salmonella spp. y otros agentes infecciosos en comparación con las dietas a base de mamíferos. El saco vitelino es la principal fuente de calcio y vitaminas liposolubles, por lo tanto, los polluelos de un día de edad deben ser alimentados a las aves rapaces con el saco vitelino intacto (Chitty 2008, Bird 1976). Desafortunadamente la yema de huevo es también una fuente rica en colesterol y los polluelos con sacos vitelinos intactos no deben ser alimentados más de dos veces por semana a largo plazo (N. Forbes, comunicación escrita, Septiembre 2015).
Las aves rapaces no se deben alimentar con palomas, ya que varios agentes infecciosos incluyendo las Trichomonas* spp., el herpesvirus del halcón y la tuberculosis pueden potencialmente ser transmitidos (Forbes 2015, Murray 2014, Redig 2009, Cooper 2002 ).
*Nota del editor: Con respecto a la tricomoniasis, algunos veterinarios reportan una exitosa reducción o prevención de la transmisión, al alimentar con palomas que han sido congeladas y luego descongeladas. En el momento de este anuncio, no hay referencias primarias que realmente demuestren que los protozoos son eliminados después de la congelación. Además, en un estudio T. gallinae mostró ser muy resistente a los daños causados por la congelación y fue la única tricomona que sobrevivió a la congelación y descongelación durante 6 meses, incluso sin la ayuda de glicerol como protector (McEntegart 1954).
Hay un estudio realizado por Bailey et al, en el que la congelación durante 24 horas de cadáveres de palomas infectadas por T. gallinae, inactivó las tricomonas, lo que podría reducir el riesgo de transmisión de la enfermedad (Bailey et al 2000). Varias fuentes también recomiendan que el buche, el esófago cervical y la cabeza sean removidas de los cadáveres de paloma congeladas/descongeladas antes de la alimentación para disminuir el riesgo de transmisión, aunque esta práctica no puede eliminar por completo el riesgo ya que las tricomonas pueden estar presentes en otros tejidos en el estado de enfermedad (Ford 2010, Ford et al 2009, Forbes 2008).
Pescado
La trucha silvestre entera y fresca es ideal para las aves rapaces que se alimentan de peces, ya que los peces de cultivo son generalmente mucho más altos en grasa (Chitty 2008). Se debe suplementar el pescado congelado/descongelado con vitamina B1, ya que la activación de la tiaminasa destruye la vitamina disponible (Chitty 2008). Suplemente la tiamina a 30 mg/kg de pescado alimentado por vía oral cada 24-48 horas (Murray 2014, Joseph 2006, Cooper 2002).
Almacenamiento y manejo de las presas
Mantenga de manera higiénica todas las herramientas y el equipo para el almacenamiento de los alimentos (Chitty 2008). Los utensilios, las tablas de cortar, los envases de alimentos, las tablas y los guantes deben limpiarse y desinfectarse diariamente (Crissey 2001). Las operaciones que alimentan regularmente presas completas, deben mantener refrigeradores y congeladores dedicados al almacenamiento de la carne (Figura 13) (Crissey 2001).

Figura 13. Almacene los alimentos en un congelador de almacenamiento dedicado a la carne. Foto proporcionada por el Centro de Vida Silvestre de Virginia. Haga clic en la imagen para ampliar .
Congelación de los alimentos
Parcialmente destripe la presa muerta inmediatamente antes de la congelación, ya que las bacterias en el tracto gastrointestinal son propensas a contaminar la carne. No remueva el hígado, el riñón y el corazón (Chitty 2008). Congele rápidamente la presa para evitar el crecimiento excesivo de bacterias (Forbes 2015) en un congelador mantenido entre los -30 a -18 ° C (-22 a 0 ° F ) (Crissey 2001, AZA NAG). Las temperaturas superiores a los -9 ° C (16 ° F) y por debajo del punto de congelación pueden afectar negativamente la apariencia y el contenido de nutrientes de los alimentos (Crissey 2001). La carne almacenada puede mantenerse durante períodos prolongados (p. ej. hasta un año) en un congelador, manteniendo la temperatura a los -23 ° C (-10 ° F) o menos. No hay estudios que den recomendaciones del tiempo de almacenamiento de presas enteras (Crissey 2001), sin embargo, el pescado congelado no se debe mantener por más de 4-6 meses (Bernard, 1997).
Descongelación de los alimentos
La congelación tiende descomponer los tejidos, haciendo que los alimentos sean más susceptibles a la invasión bacteriana después de la descongelación (Crissey 2001). La descongelación incorrecta aumenta el potencial no sólo de proliferación bacteriana, sino también la pérdida de nutrientes, pérdida de palatabilidad y la peroxidación lipídica o ranciedad (Crissey 2001). NUNCA descongele la carne a una temperatura ambiente (Crissey 2001, Bernard 1997). Utilice agua para descongelar la carne sólo en situaciones de emergencia, ya que este método aumenta la pérdida de nutrientes. El método más seguro y preferido para descongelar presas es el uso de un refrigerador limpio a 2-3.5 ° C (36-38 ° F) durante 24-48 horas (Forbes 2015, Chitty 2008, Crissey 2001, AZA NAG). La humedad relativa debe mantenerse a 85-90% en espacios refrigerados (Crissey 2001). La carne fresca o descongelada debe utilizarse dentro de 24 horas (Crissey 2001). Nunca se debe descongelar, eviscerar y volver a congelar los alimentos.
Monitoreo del paciente
El monitoreo cuidadoso del paciente permite que la cantidad de alimento sea ajustada según sea necesaria (Dierenfeld 2014). Evalúe el peso corporal y el índice de condición corporal cuidadosamente y de forma regular. También evalúe las egagrópilas y los excrementos de cerca. Recuerde que una reducción de la masa muscular pectoral puede atribuirse a una menor actividad, incluso con una dieta adecuada.
Los excrementos de las aves rapaces generalmente consisten en heces color marrón oscuro a negro, rodeadas de uratos blancos y una pequeña cantidad de orina clara. Las heces pueden ser de color marrón en las aves alimentadas con polluelos de un día de edad (Figura 14) (Redig 2009, Joseph 2006). Las heces pueden ser más aguadas cuando no se alimenta al ave con material no digerible (Cooper 2002).

Figura 14. Una cantidad relativamente grande de orina y heces de color marrón producidas por un ave alimentada polluelos de un día de edad. Foto proporcionada por la Dra. Elizabeth Daut. Haga clic en la imagen para ampliar .
El volumen, la apariencia y el momento de producción de una egagrópila varía con la especie, la dieta, y el ave individual (Figura 2) (Chitty 2008). Los búhos generalmente regurgitan una egagrópila por cada comida. Los halcones y gavilanes a menudo regurgitan una egagrópila por cada dos o tres comidas, dependiendo de la dieta con que son alimentados, con menor frecuencia si son alimentados con polluelos o mayor frecuencia si son alimentados con roedores. Múltiples egagrópilas pueden ser producidas si el alimento es muy grande (Duke 1996, Duke 1976 Balgooyen 1971). Las aves rapaces alimentadas con ratones blancos de laboratorio producen egagrópilas de color marrón, mientras que las egagrópilas de las aves silvestres tienden a ser más oscuras. Las egagrópilas frescas pueden estar cubiertas con mucosidad y de vez en cuando algunas manchas de bilis en la superficie. La egagrópila normal debe ser inodora.
La falta de producción de egagrópilas puede indicar la disfunción del tracto gastrointestinal. La producción de una egagrópila ocurre dentro de 12-16 horas después de la alimentación (Chitty 2008), sin embargo, el rango puede variar ampliamente según la especie, el estado de salud individual y el alimento. Un halcón de cola roja adulto y sano puede regurgitar una egagrópila 24-48 horas después de una comida grande (D. McRuer, comunicación escrita, Diciembre 2015).
Agua
Las aves rapaces silvestres adquieren la mayor parte de sus necesidades diarias de agua a través de su dieta, sin embargo, las aves rapaces en cautiverio siempre deben tener acceso a agua potable fresca (Forbes 2015, Chitty 2008). Considere retirar el plato de agua antes de volar al ave para evitar la saturación de agua de las plumas (Chitty 2008). Asegúrese que los recipientes de agua puedan ser fácilmente desinfectados (Forbes 2015).
Resumen
El intestino del ave rapaz es un sistema bastante simple con un ventrículo poco desarrollado y un intestino grueso o ciego relativamente subdesarrollado. Sin embargo, el tracto gastrointestinal funcional del ave rapaz es exigente metabólicamente y requiere de alta energía y humedad, debido a la formación de material indigestible compactado o egagrópilas. El manejo las aves rapaces débiles y demacradas incluye minimizar el estrés, proporcionar calor suplementario, fluidoterapia y la administración de suplementos de tiamina y otras vitaminas del complejo B. El soporte nutricional no debe iniciarse hasta que el paciente se encuentre cálido y el déficit de hidratación/electrolitos se haya corregido. Las pruebas de diagnóstico iniciales también puede ser retrasadas si el paciente se encuentra muy debilitado. Las aves rapaces débiles son alimentadas a través de una sonda inicialmente. Cuando el paciente empieza a comer alimentos sólidos, se pueden ofrecer conejos, roedores como ratones y/o ratas, polluelos de un día de edad y codornices del género Coturnix disponibles en el mercado.
**Inicia sesión para ver las referencias**
Referencias
Referencias
AZA Nutrition Advisory Group. NAG Carcass Feeding Statement. NAG website. Available at http://nagonline.net/guidelines-aza-institutions/nag-carcass-feeding-statement/. Accessed on June 24, 2015.
Balgooyen TG. Pellet regurgitation by captive sparrow hawks (Falco sparverius). Condor 73(3):382-385, 1971.
Bailey TC, Samour JH, Bailey TA, et al. Trichomonas sp. and falcon health in the United Arab Emirates. In: Lumeij JT, Remple JD, Redig PT, et al. (eds). Raptor Biomedicine III including Bibliography of Diseases of Birds of Prey, 3rd ed. Lake Worth, FL: Zoological Education Network; 2000: 53-57.
Barton NW, Houston DC. A comparison of digestive efficiency in birds of prey. Ibis 135 (4):363–371, 1993.
Bernard JB, Allen ME. 1997. Feeding captive piscivorous animals: nutritional aspects of fish as food. In Nutrition Advisory Group Handbook Fact Sheet 005. 1997. Disponible en http://nagonline.net/810/feeding-captive-piscivorous-animals-nutritional-aspects-fish-food/. Consultado Junio 24, 2015.
Bird DM, Ho SK. Nutritive values of whole-animal diets for captive birds of prey. Raptor Res 10(2):45–49, 1976.
Chitty J. Raptors: nutrition. In: Chitty J, Lierz M (eds). BSAVA Manual of Raptors, Pigeons and Passerine Birds. Gloucester, UK: BSAVA; 2008.
Cooper JE. Nutritional diseases, including poisoning, in captive birds. In: Birds of prey: health and disease. 3rd edition. Oxford: Blackwell Science Ltd; 2002: 143–62.
Crissey SD, Slifka KA, Shumway P, Spencer SB. Handling Frozen/Thawed Meat and Prey Items Fed to Captive Exotic Animals. USDA Animal and Plant Inspection Service. National Technical Information Service, 5285 Port Royal Road, Springfield, NA 22161. 2001. Disponible en http://www.aphis.usda.gov/animal_welfare/downloads/big_cat/handlemeat.pdf. Consultado Junio 24, 2015.
Crissey SD, Slifka KA, Lintzenich BA. Whole body cholesterol, fat, and fatty acid concentrations of mice (Mus domesticus) used as a food source. J Zoo Wildl Med 30(2):222-227, 1999.
Denbow DM. Gastrointestinal anatomy and physiology. In: Whittow GC (ed).
Sturkie’s Avian Physiology. 5th ed. San Diego (CA): Academic Press; 2000: 299–325.
Dierenfeld ES, Alcorn HL, Jacobsen KL. Nutrient composition of whole vertebrate prey (excluding fish) fed in zoos. Nat Agric Libr Z7994, Z65, p. 20. Available at http://nagonline.net/3112/nutrient-composition-of-whole-vertebrate-prey-excluding-fish-fed-in-zoos/. Accessed July 9, 2015.
Dobbs J. 1983. Glucose utilization in an avian carnivore, the red tailed hawk, as measured by glucose tolerance tests. PhD thesis. Avian Sci Dept. UC Davis, CA.
Douglas TC, Pennino M, Dierenfeld ES. Vitamins E and A, and proximate composition of whole mice and rats used as feed. Comp Biochem Physiol 107(2):419-424, 1994.
Duke GE. Gastrointestinal physiology and nutrition in wild birds. Proc Nutr Soc 56:1049-1056, 1997.
Duke GE, Evanson OA, Jegers A. Meal to pellet intervals in 14 species of captive raptors. Comp Biochem Physiol 53(1):1–6, 1976.
Duke GE, Tereick AL, Reynhout JK, et al. Variability among individual American kestrels (Falco sparverius) in parts of day-old chicks eaten, pellet size, and pellet egestion frequency. J Raptor Res 30(4):213-218, 1996.
Forbes NA. Raptor nutrition. Proc International Conference on avian herpetological and exotic mammal medicine. 2015;33-36.
Forbes NA. Raptors: Parasitic disease. In: Chitty J, Lierz, M (eds). BSAVA Manual of Raptors, Pigeons and Passerine Birds. 2nd ed. Gloucester (MA): British Small Animal Veterinary Association; 2008: 202-211.
Ford S. Raptor gastroenterology. J Exot Pet Med 19(2):140-150, 2010.
Ford S, Chitty J, Jones MP. Raptor Medicine Master Class. Proc Annu Conf Assoc Avian Vet. 2009;143-162.
García-Rodríguez T, Ferrer M, Carrillo JC, et al. Metabolic responses of Buteo buteo to long-term fasting and refeeding. Comp Biochem Physiol 87A(2):381–386, 1987.
Handrich Y, Nicholas L, Le Maho Y. Winter starvation in captive common barn owls: physiological states and reversible limits. Auk 110(3):458–469, 1993.
Hayes G, Benedicenti L, Mathews K. Retrospective cohort study on the incidence of acute kidney injury and death following hydroxyethyl starch (HES 10% 250/0.5/5:1) administration in dogs (2007-2010). J Vet Emerg Crit Care 26(1):35-40, 2016.
Huynh M, Sabater M, Brandão J, Forbes NA. Use of an esophagostomy tube as a method of nutritional management in raptors: a case series. J Avian Med Surg 28(1):24-30, 2014.
Joseph V. Raptor medicine: an approach to wild, falconry, and educational birds of prey. Vet Clin North Am Exot Anim Pract 9(2):321-345, 2006.
Kirkwood JK. Maintenance energy requirements and rate of loss during starvation in birds of prey. In: Cooper JE, Greenwood AG (eds). Recent Advances in Raptor Diseases. Chiron Publ. Keighly. UK; 1981
Klasing KC. Comparative Avian Nutrition. New York: CABI Publishing; 1998.
Kubiak M, Forbes N. Effects of diet on total calcium, vitamin D and parathyroid hormone in falcons. Vet Rec 171(20):504, 2012.
Labato, MA. 1992. Nutritional management of the critical care patient. In Kirk, RW, Bonagura, JD (eds). Current Veterinary Therapy XI. WB Saunders Co: 117-124.
McCray S, Walker S, Parrish, CR. Much ado about refeeding. Practical Gastroenterology 5: 26-44, 2005.
McEntegart MG. The maintenance of stock strains of trichomonads by freezing. J Hyg 52(4):545-550, 1954.
McLelland J. Digestive system. In: King AS, McLelland J, editors. Form and Function in Birds, vol. 1. London: Academic Press; 1979: 69–181.
Murray M. Raptor gastroenterology. Vet Clin North Am Exot Anim Pract 17(2):211-234, 2014.
O’Donnell JA, Garbett R, Morzenti A. Normal fasting plasma glucose levels in some birds of prey. J Wildl Dis 14(4):479-481 1978.
Redig PT, Cruz-Martinez L. Raptors. In: Tully TN, Dorrestein GM, Jones AK (eds).Handbook of Avian Medicine, 2nd ed. New York: Saunders Elsevier;2009: 209-242.
Rodríguez A, Negro JJ, Figuerola J. Sources of variation for nutritional condition indices of the plasma of migratory lesser kestrels in the breeding grounds. Comp Biochem Physiol A Mol Integr Phsyiol 160(4):453-460, 2011
Shapiro CJ, Weathers WW. Metabolic and behavioral responses of American kestrels to food deprivation. Comp Biochem Physiol 68A(1):111–114, 1981.
Further Reading
Barton NW, Houston DC. A comparison of digestive efficiency in birds of prey. Ibis 135(4):363-371, 1993.
Braun EJ, Sweazea KL. Glucose regulation in birds. Comp Biochem Physiol 151(1):1–9, 2008.
Chaplin SB. Effect of cecectomy on water and nutrient absorption of birds. J Exp Zool Suppl 3:81-86, 1989.
Denbow DM. Gastrointestinal anatomy and physiology. In: Whittow GC (ed). Sturkie’s Avian Physiology, 5th ed. San Diego (CA): Academic Press; 2000: 299–325.
Duke GE, Bird JE, Daniels KA, et al. Food metabolizability and water balance in intact and cecectomized great-horned owls. Comp Biochem Physiol 68(2):237-240, 1981.
Duke GE, Fuller MR, Huberty BJ. The influence of hunger on meal to pellet intervals in barred owls. Comp Biochem Physiol 66(2):203-207, 1980.
Facon C, Beaufrere H, Gaborit C, et al. Cluster of atherosclerosis in a captive population of black kites (Milvus migrans subsp.) in France and effect of nutrition on the plasma lipid profile. Avian Dis 58(1):176-182, 2014.
Fuller MR, Duke GE, Eskedahl DL. Regulation of pellet egestion: the influence of feeding time and soundproof conditions on meal to pellet intervals of red-tailed hawks. Comp Biochem Physiol 62(2):433-438, 1979.
King AS, McLelland J. Digestive system. In: Birds: their structure and function. 2nd ed. London: Bailliere Tindall; 1984: 84–109.
Klaphake E, Clancy J. 2005. Raptor Gastroenterology. Vet Clin North Am Exot Anim Pract 8(2):307-327, 2005.
Migliorini RH, Linder C, Moura JL, et al. Gluconeogenesis in a carnivorous bird (black vulture). Am J Physiol 225:1389-1392, 1973.
Myers MR, Klasing KC. Low glucokinase activity and high rates of gluconeogenesis contribute to hyperglycemia in barn owls (Tyto alba) after a glucose challenge. J Nutr 129(10):1896-1904, 1999.
Orosz SE. 2008. Critical Care Nutrition for Birds. Proc Annu Conf MASSAV. Williamsburg, VA: 208-214.
Quesenberry KE, Maudlin G, Hillyer EV. 1991. Review of methods of nutritional support in hospitalized birds. Proc Annu Conf European Assoc Avian Vet. Vienna: 243-254.
Tabaka CS, Ullrey DE, Sikarskie JG, et al. Diet, cast composition, and energy and nutrient intake of red-tailed hawks (Buteo jamaicensis), great horned owls (Bubo virginianus), and turkey vultures (Cathartes aura). J Zoo Wildl Med 27(2):187-196, 1996.
Veiga JA, Roselino ES, Migliorini RH. Fasting, adrenalectomy, and gluconeogenesis in the chicken and a carnivorous bird. Am J Physiol 234(3):115-121, 1978.
