Points clés
- Les rapaces ingèrent des proies entières. Le matériel indigestible ou « cure », comme les poils, les plumes et les os, est retenu au sein du ventricule du rapace, compacté en une pelote et régurgité ou rejetée.
- La réjection peut avoir lieu aussi rapidement que 18 à 12 heures après un repas. L’oiseau ne doit pas être réalimenté tant qu’il n’a pas produit de pelote.
- L’émaciation est un motif de présentation fréquent chez les jeunes rapaces qui n’ont pas été capables de chasser correctement au cours de leur première année de vie. Les oiseaux peuvent également être présentés en mauvaise condition consécutivement à une variété d’autres causes incluant une activité météorologique peu clémente ou une blessure chronique.
- L’anémie et l’hypoprotéinémie sont des découvertes cliniques fréquentes chez les oiseaux de proie chroniquement mal nourris.
- Alors que les maladies sévères et le stress conduisent souvent à un état hypermétabolique, le métabolisme se ralentit chez les patients mal nourris ou au jeûne.
- Les oiseaux de proie peuvent survivre à une pénurie alimentaire pendant une période de temps plus longue que les perroquets ou les passereaux. Les plus petits rapaces sont moins tolérants au jeûne que les plus grands oiseaux.
- Les soins de soutien pour les rapaces chroniquement mal nourris incluent une fluidothérapie et l’apport de chaleur supplémentaire. La minimisation du stress est également critique pour les patients faibles et émaciés.
- Dès lors que le patient possède un tractus gastro-intestinal fonctionnel, la nutrition entérale peut généralement être commencée une fois que le patient est réchauffé et correctement hydraté.
- Retirer le matériel indigestible ou “cure” si l’oiseau est maigre, si des traitements sont donnés plusieurs par jour ou si l’oiseau est très jeune (moins de 3 semaines d’âge).
- La plupart des rapaces consommeront toute source de viande appropriée lorsque leur aliment de préférence n’est pas disponible, du moment que la proie est dépecée. Toutefois, les balbuzards nécessitent souvent d’être alimentés à la main en captivité.
- Bien que relativement dispendieux, les souris et les rats sont fréquemment utilisés pour nourrir les oiseaux de proie. Les souris et les rats élevés en captivité tendent à être relativement riches en matières grasses.
- Les poussins de un jour qui sont servis avec le sac vitellin intacts représentent une source adéquate de protéine et de calcium ainsi qu’une bonne source de vitamines liposolubles.
- Les pigeons et les colombes ne devraient pas être utilisés pour nourrir les rapaces car de nombreux agents infectieux peuvent être transmis.
- La méthode la plus sécuritaire et qui devrait être retenue pour décongeler des aliments potentiellement dangereux, tels que des souris congelées, est d’utiliser un réfrigérateur propre et spécifiquement désigné pour décongeler les proies sur 24 à 48 heures.
- Assurer un suivi attentif du patient recevant un support nutritionnel en évaluant son poids corporel, sa note d’état corporel, ses fientes et sa production de pelote.
- Les rapaces sauvages trouvent la plupart de leur besoin hydrique quotidien par leur alimentation. Toutefois, les rapaces captifs devraient toujours avoir accès à de l’eau de boisson fraîche.
Introduction
Les rapaces, ou oiseaux de proie, forment un groupe diversifié qui inclue les chouettes et les hiboux, les faucons, les aigles, les buses, les milans et les vautours (Fig 1).

Figura 1. Le groupe connu sous le nom de rapaces, ou oiseaux de proie, est un groupe diversifié. Crédit photographique: Dr Elizabeth Daut (left), Beka Weiss via Flickr Creative Commons (FCC) (middle), et John Haslam via FCC (right). Cliquer sur l’image pour l’agrandir.
Tous les rapaces consomment une ration alimentaire carnée que ce soit un régime spécialiste, par exemple dans la consommation de poisson comme chez le balbuzard (Pandionhaliaetus) ou un régime alimentaire généraliste pouvant inclure des insectes, des mammifères, des oiseaux, des reptiles, des amphibiens, et même des carcasses. A l’exception des volailles, les besoins nutritionnels exacts des oiseaux ne sont pas connus. Toutefois, la ration alimentaire naturelle des rapaces est toujours relativement élevée en protéines et en matières grasses et faible en carbohydrates. Des régimes constitués de proies entières ont un rapport phosphocalcique de 1.5 :1 car l’oiseau consomme en réalité les os ainsi que la viande (Kubiak 2012, Bird 1976).
Spécialisation du tractus gastro-intestinal chez les rapaces
Le tractus gastro-intestinal tract supérieur des rapaces est fondamentalement différent par rapport à celui observé chez les oiseaux omnivores et granivores tels que les perroquets et les poulets.
- La plupart des rapaces diurnes possèdent un jabot en forme de fuseau qui est particulièrement bien développé chez les vautours. Les hiboux et les chouettes (Ordre : Strigiformes) ne possèdent pas de jabot. Toutefois, la nourriture peut être stockée au sein de l’œsophage (Murray 2014, Klasing 1998, Duke 1997, McLelland 1979).
- L’estomac peut se distendre pour contenir de grandes proie, grâce à la présence de crêtes muqueuses sur la surface séreuse du proventricule. Le ventricule possède une paroi fine et faiblement musclée, notamment lorsqu’elle est comparée à celle des oiseaux granivores qui utilisent leur ventricule pour broyer des céréales et des graines. (Murray 2014, Denbow 2000, Duke 1997, McLelland 1979).
- Les matériaux indigestibles comme les poils, les plumes et les os, sont retenus dans le ventricule, compactés en un pelote et régurgité ou rejeté (Fig 2)(Forbes 2015, Murray 2014, Duke 1997).
Evaluation du statut nutritionnel
Note d’état corporel
La note d’état corporel (NEC) reflète les modifications de composition corporelle et le statut nutritionnel d’une façon bien meilleur que le poids seul. L’évaluation de la note repose sur la palpation de la musculature pectorale, la visualisation des réserves de tissu adipeux sous-cutané et la palpation de tissu adipeux cœlomique. L’échelle des NEC chez les oiseaux est parfois graduée de 1 (émaciation) à 5 (obésité). L’excédent énergétique ou obésité, est plus fréquemment observé chez les oiseaux captifs logés en permanence en volière de reproduction ou en parc zoologique (Forbes 2015, Chitty 2008). Bien que la musculature pectorale puisse être atrophiée suite à un défaut d’utilisation secondaire à un jeune âge ou à une blessure, le patient émacié perd typiquement au moins un tiers de son poids corporel normal et apparait anormalement fin (Fig 3).
L’émaciation est une présentation fréquente chez les rapaces qui n’ont pas appris à chasser avec succès au cours de leur première année de vie. Les oiseaux peuvent également se présenter en mauvaise condition suite à une grande variété de causes telles qu’une incapacité à chasser ou à consommer de la nourriture, un temps peu clément, une blessure chronique ou lorsqu’ils se retrouvent piégés dans un bâtiment ou une autre structure crée par la main de l’homme. (Murray 2014, Handrich 1993, Garcia-Rodriguez 1987, Shapiro 1981). Les déficits énergétiques peuvent également être observés chez les oiseaux de fauconnerie comme le résultat de pratique d’entraînement inappropriées (Chitty 2008).

Figure 3. Emaciation (NEC 1) chez une buse à queue rousse âgée d’un an (Buteo jamaicensis). Crédit photographique: Dr Elizabeth Daut. Cliquer sur l’image pour l’agrandir.
Analyses sanguines
Différer les tests approfondis jusqu’à ce que le patient soit suffisamment stable pour tolérer le stress de la contention et de la prise de sang. Les examens de laboratoire initiaux incluent souvent une hématologie, l’examen d’un frottis sanguin à la recherche de parasite, la mesure des protéines totales, de l’hématocrite, de la glycémie et idéalement des créatinine kinase, lactate déhydrogénase, aspartate transaminase ainsi que des électrolytes. L’anémie et l’hypoprotéinémie sont des découvertes fréquentes chez l’oiseau de proie chroniquement mal nourrit (Fig 4) (Murray 2014, Redig 2009).
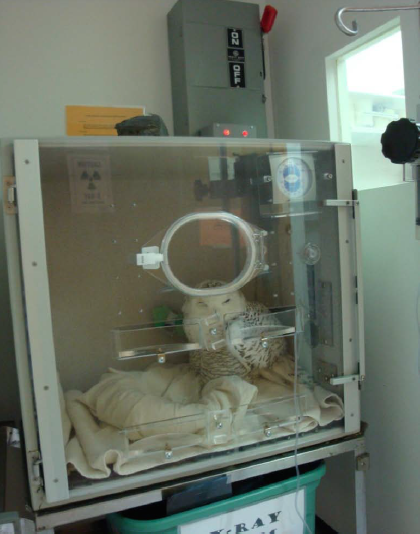
Figure 4. Harfang des neiges (Bubo scandiacus) rehabilitée aux Centre pour la Faune Sauvage de Virginie. Les examens initiaux révèlent un taux de protéines totales de 60 mg/L, un hématocrite de 16% et une glycémie à 1,01 g/L. Crédit photographique : Dr Elizabeth Daut. Cliquer sur l’image pour l’agrandir.
Les taux de glucose sanguin normaux peuvent être assez variables chez les rapaces. La glycémie dépasse habituellement 1.5 g/L (8.33 mmol/L) chez les oiseaux en bonne santé et peut être aussi élevée que 8 g/L (44.44 mmol/L) chez les espèces les plus petites. Des crises convulsives peuvent être observées si le taux de glucose descend en dessous de 0.8 g/L (4.44 mmol/L). Heureusement, la glycémie tend à être maintenue dans les intervalles normaux pendant une période de temps relativement longue chez le rapace qui jeûne (O’Donnell 1978).
Examens complémentaires
Réalisez un test à la recherche de parasites fécaux (cytologie sur montage frais/flottaison), en particulier chez les oiseaux maigres. Administrer un anti-helmintique au besoin. (Murray 2014). Les éléments d’information recueillis lors de l’anamnèse et de l’examen physique peuvent également orienter vers des examens diagnostiques additionnels tels que des radiographies et/ou une endoscopie.
Besoins métaboliques lors du jeûne en comparaison avec le stress
Jeûne
Le jeûne est associé à une diminution graduelle du taux métabolique ayant pour résultat un hypométabolisme. Lors du jeûne, le patient essaye de maintenir un taux de glucose sanguin normal en augmentant la glycogénolyse et la gluconéogénèse, ce qui s’accompagne d’une réduction des réserves en glycogène. Lorsque les réserves de glycogènes sont épuisées, les muscles et les matières grasses sont dégradés pour fournir un substrat à la gluconéogénèse. Le jeûne affecte finalement la masse protéique viscérale et le fonctionnement des organes vitaux (Parrish 2005).
Les réserves de glycogène sont généralement épuisées en 24 heures de jeûne chez les oiseaux granivores. Toutefois, des recherches ont montré que les rapaces pouvaient être relativement tolérants face à une privation aiguë de nourriture. Malgré une perte de masse musculaire moyenne de 28% et 26% au cours d’une période de jeune de 8 et 13 jours respectivement chez des effraie des clochers (Tyto alba) et des buses variables (Buteo buteo), ces oiseaux étaient toujours capable de voler et de se nourrir spontanément lorsque de la nourriture était réintroduite (Handrich 1993, Garcia-Rodriguez 1987). Aucun changement significatif de l’hématocrite ou des protéines totales n’ont été observé chez les buses mises au jeûne (Garcia-Rodriguez 1987). Au contraire, des Crécerelles d’Amérique (Falco sparverius) privées de nourriture pendant 3 jours, ont perdu 17-20% de leur masse corporelle tandis que leur métabolisme et leur température corporelle diminuaient tous les deux. Les chercheurs ont conclu de cet essai que les crécerelles seraient mortes si le jeûne avait duré 5 jours (Shapiro 1981).
Hypermétabolisme
Lors de stress physiologique, comme lors de maladie sévère, la source d’énergie préférentielle est la masse corporelle maigre, ce qui résulte en une augmentation du catabolisme protéique. Les besoins énergétiques sont augmentés de 30 à 50% pour soutenir les réparations tissulaires, les processus inflammatoires et la fonction immunitaire. La libération de catécholamines, de glucagon et de glucocorticoïdes augmente le taux de gluconéogénèse et de glycogénolyse, augmentant encore davantage le taux métabolique (Labato 1992). Très peu de connaissances sont disponibles sur l’état hypermétabolique chez les oiseaux en général ou chez les rapaces en particulier, mais ces mêmes principes sont considérés être vrais.
Soins de support
Les soins de support pour les rapaces chroniquement mal nourris ou émaciés devraient inclure une fluidothérapie, l’apport de chaleur supplémentaire et des mesures permettant de minimiser le stress. En plus des mesures habituelles de réduction du stress associées à l’hospitalisation d’espèces inhabituelles*, les rapaces peuvent également être calmés en recouvrant délicatement la tête avec une serviette ou avec un chaperon de fauconnerie (Fig 5).

Figure 5.Les chaperons de fauconnerie sont fréquemment utilisés pour calmer les oiseaux de proie. Crédit photographique: Andreas Praefcke via Wikimedia Commons. Cliquer sur l’image pour l’agrandir.
*Note de l’Editeur: Voire Régie de base: Hospitalisation des animaux de compagnie non traditionnels et Soins intensifs pour les animaux exotiques : Soins Infirmiers pour le Patient Aviaire pour obtenir des informations complémentaires.
Fluides
La plupart des patients présentés dans les centres de réhabilitation de la faune sauvage présentent une déshydratation d’au moins 5% et de nombreux rapaces maigres ou mal nourris peuvent être déshydratés jusqu’à 12%. L’état d’hydratation sera graduellement normalisé sur 24 à 48 heures, mais des pertes continues et persistantes nécessitent d’être compensées plus rapidement. Consulter la page traitant de la Fluidothérapie chez le Patient Aviaire pour davantage d’information.
Les fluides sous-cutanés représentent une voie efficace d’administration pour les patients légèrement malades. Placez un cathéter intraveineux ou intra-osseux chez les patients plus débilités, mais gardez à l’esprit qu’il existe un risque de surcharge volumique chez le patient hypoprotéinémique. Supplémentez les patients avec de la thiamine et autres vitamines du groupe B avant et pendant la phase initiale de réalimentation (thiamine 1–2 mg/kg SC toutes les 24 heures)(Murray 2014). L’administration d’un support hydrique d’entretien est souvent continuée pendant 3 à 5 jours après que l’alimentation soit réinstaurée. La transfusion sanguine représente également une option chez certains patients présentant une anémie sévère et une hypoprotéinémie.
Chaleur supplémentaire
L’hypothermie est très fréquente chez les rapaces débilités et émaciés. Apportez une source de chaleur supplémentaire pour éviter à l’oiseau de dépenser de l’énergie pour sa thermorégulation. Des fluides intraveineux ou intra-osseux chauds et une unité de soins intensifs chauffée peuvent augmenter à la fois la température centrale et périphérique.
Indications pour un support nutritionnel
L’administration d’un support nutritionnel est indiquée dans des situations allant d’une perte de poids sévère et une anorexie à une maladie sévère ou des blessures (Table 1).
| Table 1. Indications pour un support nutritionnel |
|---|
|
Calculer les besoins énergétiques
Le taux métabolique basal (TMB) représente la quantité minimum d’énergie, ou kilocalorie (kcal) nécessaire pour maintenir le corps au repos, ou en d’autres termes, l’énergie minimum pour rester en vie. Une estimation du TMB repose sur une échelle métabolique où le TMB=K x (Poids(en kg))^0.75. Le facteur K est une constante théorique pour les kilocalories utilisées en 24 heures. Chez les oiseaux non passereaux, le K est de 78 (Murray 2014).
Le besoin énergique de maintenance (BEM) est égal au TMB auquel s’ajoute l’énergie nécessaire à une activité physique normale, la digestion et la thermorégulation. Le BEM est estimé à 1.5xTMB (Forbes 2015, Murray 2014, Kirkwood 1981). Les oiseaux les plus grands consomment davantage de nourriture mais ont besoin d’une prise alimentaire quotidienne représentant un pourcentage significativement plus petit de leur poids corporel.(Forbes 2015).
Alimentation à la sonde
Dès lors que le patient possède un tractus gastro-intestinal fonctionnel, la nutrition entérale peut être commencée une fois que le patient est réchauffé et correctement hydraté (Murray 2014). Des fluides contenant des électrolytes tels que le Pedialyte (Abbott) sont parfois administrés avant de commencer l’alimentation à la sonde. Evitez les solutions riches en glucose dans la mesure où les rapaces trouvent peu de glucose dans leur régime alimentaire normal. Des recherches indiquent que des solutions glucosées peuvent précipiter le décès des oiseaux de proies débilités. (Dobbs 1983). Consultez l’algorithme proposé par le Dr Scott Ford offrant une synthèse pratique de l’approche relative au soutien nutritionnel chez les oiseaux de proie (Fig 6).

Figure 6. Algorithme de réalimentation et de réanimation liquidienne chez les rapaces. Cliquer sur l’image pour l’agrandir. Source: Dr Scott Ford. Cliquer ici pour télécharger une version PDF(112 KB)
* Note de l’Editeur: L’Union Européenne a recommandé d’interdire l’utilisation de l’hetastarch (hydroxyethyl starch ou HES) chez les patients humains et l’Administration américaine chargée des aliments et des médicaments a instauré une « mise en garde encadrée ». Ces colloïdes ont été associés à l’apparition de lésions rénales aiguës et de coagulopathies chez certains patients septiques. Une étude vétérinaire récente a également mis en évidence un risque augmenté d’effet indésirable incluant la mort ou des lésions rénales aiguës chez les chiens recevant un traitement HES (Hayes 2016). Certains vétérinaires ont complètement éliminé l’utilisation des colloïdes de leur pratique alors que d’autres ont sélectionné des HES de bas poids moléculaire, tel que le Voluven™ (Hospira) ou le Vetstarch™ (Abbott Labs).
Les formules d’alimentation à la sonde les plus fréquemment utilisées chez les oiseaux de proie regroupent les régimes de soins intensifs Emeraid Carnivore (Emeraid LLC), ainsi que les régimes de convalescence tels que le Carnivore Care (Oxbow), le a/d Canin/Félin Soins Intensifs (Hill’s), et le Maximum-Calorie (Iams). Divisez le besoin calorique du patient par le contenu énergétique de la formule d’alimentation à la sonde (calories par ml) pour déterminer le volume total de formule à administrer par jour. Augmenter graduellement sur au moins 2-3 jours la quantité totale de nourriture administrée quotidiennement jusqu’à ce que le patient reçoive son BEM (Encadré 1). Les patients débilités reçoivent typiquement des plus petits volumes d’aliment, administrés trois à quatre fois par jour (Murray 2014). Chez les oiseaux de fauconnerie bien entraînés qui ne nécessitent pas d’être contenu, ceci peut être réalisé en utilisant un tube d’œsophagostomie (Huynh et al 2014).
| Encadré 1. Formules de calcul pour l’alimentation à la sonde |
|---|
|
Une buse à queue rousse de 900 grammes (Buteo jamaicensis) est présentée avec une fracture de l’humérus droit. Sa note d’état corporel est évaluée à 2/5.
TMB = 78 (0.9)0.75 = 72 kcal/jour Emeraid Carnivore = 1.67 kcal/ml |
Bien que le calcul du besoin calorique soit crucial, les repas doivent également prendre en considération le volume du jabot ou de l’estomac. Le volume initial administré ne devrait pas excéder environ 1-1.5% du poids corporel. Le volume administré lors du repas suivant sera augmenté à 2-3% du poids corporel, et le volume ne devrait jamais excéder 5% du poids corporel (Huynh et al2014). Lorsqu’un tube d’œsophagostomie est utilisé, un volume plus petit, n’excédant pas 1.5% est administré, en association avec une augmentation de la fréquence d’administration (N. Forbes, communication écrite, Sep 2015). Délivrez la formule à l’aide d’une sonde en caoutchouc ou une sonde de gavage métallique ou une seringue d’alimentation (Fig 7)(Encadré 2).
| Encadré 2. Volume du jabot |
|---|
|
Le volume total du jabot chez une buse de 900 grammes est estimé à 5% du poids corporel en gramme soit 50 ml/kg = 45 ml
Initialement, l’alimentation par la sonde est souvent commence à 2.5-3% du poids corporel. 25 ml/kg = 22.5 ml En conséquence, le volume de la première alimentation par la sonde devrait se trouver entre 23 et 27 ml. |
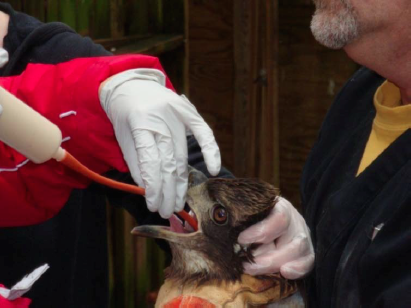
Figure 7. Alimentation à la sonde d’une buse à queue rousse (Buteo jamaicensis) avec un cathéter en caoutchouc (red rubber). Crédit photographique: Dr Elizabeth Daut. Cliquer sur l’image pour l’agrandir.
L’alimentation avec des proies
Certains oiseaux de proie malades ou blessés peuvent se nourrir spontanément dès leur présentation mais les repas ne devraient pas être administrés tant que le patient n’est pas réchauffé et réhydraté. Les rapaces adultes sont normalement alimentés une fois par jour et les oiseaux recevant des proies entières ne devraient pas être ré-alimentés tant qu’ils n’ont pas rejeté de boulette (Forbes 2015). Retirez le matériel favorisant la production de la pelote, comme les poils et les plumes, si un oiseau est en mauvaise condition ou si des médicaments sont données plusieurs fois par jour (Forbes 2015).
Une fois que les anomalies hydro-électrolytiques ont été corrigées et que le patient est capable de bien maintenir son poids corporel et semble enthousiaste de manger, réaliser une transition graduelle de l’alimentation à la sonde vers de la nourriture solide. Au départ, le repas de tels patients est souvent constitué de trois à quatre bouchées de souris ou autre proie entière, dépourvue de plumes ou de poils et trempée dans de l’eau chaude. Si le patient passe des selles d’apparence normales (voire la section « Suivi » ci-dessous) et qu’aucune complication n’est observée, alors la quantité de nourriture proposée peut être augmentée graduellement. Modifier l’alimentation en visant plusieurs petits repas par jour, et contrôler que le jabot parvient à se vider entre les repas. Sous réserve que l’oiseau ai repris une note d’état corporelle normale, continue de montrer un bon appétit et passe des fécès d’apparence normale, introduisez graduellement du matériel non digestible (Murray 2014). Une fois que le patient est stable, proposez la proie entière, incluant les organes internes pour assurer l’équilibre alimentaire de la ration (Fig 8) (Murray 2014, Klasing 1998). Les proies devraient être de taille appropriée de sorte que l’oiseau puisse consommer la proie en entier.

Figure 8. Les proies entières sont souvent d’abord proposées sous la forme d’un émincé. Crédit photographique: Dr Elizabeth Daut. Cliquez sur l’image pour l’agrandir.
Si le repas n’est pas immédiatement consommé, ne laissez pas les aliments à l’air libre pendant une période de temps prolongée car des proliférations bactériennes et des contaminations peuvent se produire(Chitty 2008). Idéalement, les aliments ne devraient pas être laissés à l’air libre plus de 30-60 minutes (Chitty 2008), et plus particulièrement lorsqu’ils sont placés en extérieur pendant les mois chauds. Si l’oiseau ne commence pas à se réalimenter spontanément, continuer l’alimentation à la seringue, proposer de la nourriture solide plus tard dans la même journée ou le lendemain, ou réaliser une alimentation assistée du patient, selon ce que dicte l’état clinique (Fig 9).

Figure 9. Alimentation assistée d’une buse avec des morceaux émincés et humidifiés de proie entière. Crédit photographique; Dr Elizabeth Daut. Cliquer sur l’image pour l’agrandir.
L’alimentation des oiseaux en croissance
Lorsque des oiseaux juvéniles, sont nourris à la main, proposez de petits morceaux de nourriture un par un, en utilisant des pinces ou des clamps. Humidifiez légèrement les morceaux d’aliments avec de l’eau et surveillez avec attention la vidange du jabot. L’élevage à la main des jeunes vautours peut représenter un défi particulier du fait de leur tendance à régurgiter sous l’effet du stress. Chitty (2008) recommande de réaliser une pré-digestion partielle des aliments en les plongeant au préalable dans un supplément pancréatique commercial pendant 30 minutes.
Les jeunes poussins sont incapables d’éjecter le matériel indigestible ou ‘boulette’ et sont donc à risque de développer une impaction proventriculaire et de mourir (Forbes 2015). Ne pas alimenter un poussin âgé de moins de 12 jours environ avec du matériel indigestible. Certaines espèces comme les faucons émerillons (Falco columbarius) ne devraient pas recevoir de matériel indigestible jusqu’à environ 20 jours d’âge (Forbes 2015). Alors que les régimes alimentaires associés à la consommation de proie entière ont un ratio calcium/phosphore (Ca :P) équivalent à 1.5 :1, la viande sans os possède un ration Ca 😛 de 1 :20 (Kubiak 2012, Bird 1976). Comme tous les animaux en croissance les poussins des rapaces ont des besoins en calcium et en vitamine D3 augmentés et sont à risque de développer un hyperparathyroïdisme secondaire nutritionnel s’ils sont alimentés avec un régime ne contenant pas assez d’os ou, alternativement, pas de supplémentation en vitamines et minéraux (Fig 10, Fig 11)(Chitty 2008). La déviation des os longs et des fractures multiples en motte de beurre (ou en tore) sont des découvertes fréquentes chez les rapaces recevant exclusivement une ration alimentaire constituée uniquement de viande. (Kubiak 2012).
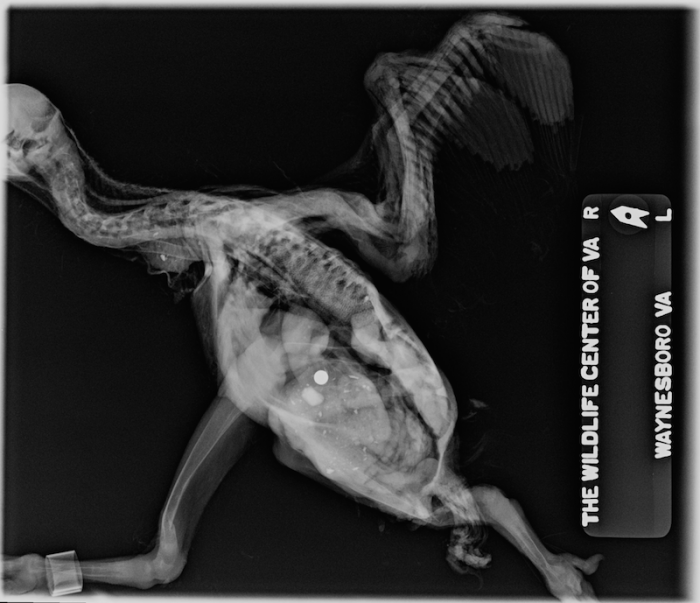
Figure 10. Vue radiographique latérale d’un urubu noir juvenile (Coragyps atratus) atteint d’hyperparathyroïdisme secondaire nutritionnel, ou maladie métabolique des os. Crédit photographique: Dr Dave McRuer, Le Centre pour la Faune Sauvage de Viriginie. Cliquer sur l’image pour l’agrandir.
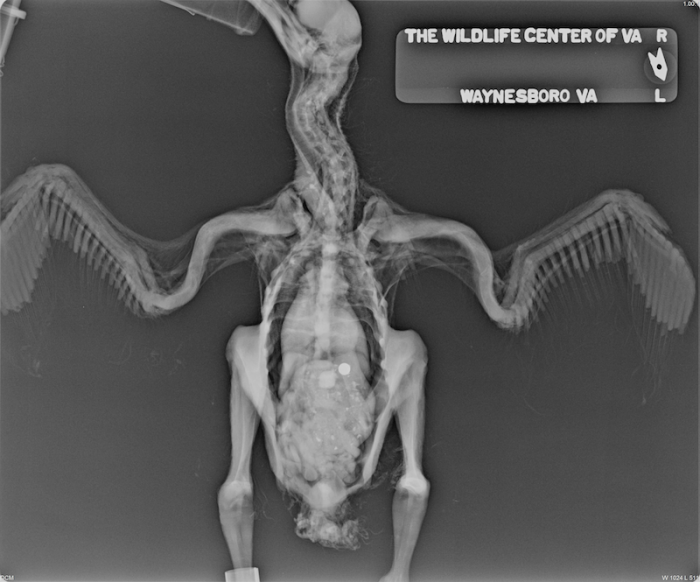
Figure 11.Vue ventrodorsale d’un urubu noir juvenile (Coragyps atratus) atteint de maladie métabolique des os. Crédit photographique: Dr Dave McRuer, Le Centre pour la Faune Sauvage de Virginie. Cliquer sur l’image pour l’agrandir.
Options pour l’alimentation avec des proies
La meilleure alimentation pour les oiseaux de proie en captivité est celle qui ressemble le plus possible à leur régime alimentaire naturel (Murray 2014, Chitty 2008, Cooper 2002). Heureusement, la plupart des rapaces en contexte de réhabilitation accepteront facilement tout type de viande appropriée lorsque leur nourriture de préférence n’est pas disponible (Murray 2014, Chitty 2008), en particulier lorsque les proies alimentaires sont dépecées ou découpées en morceaux. Les balbuzards représentent une exception notable et l’alimentation à la main est souvent nécessaire en captivité (Murray 2014).
La composition nutritionnelle des proies vertébrées entières est généralement complète et assez constante entre les différents types de proie, bien que la composition en matière grasse puisse varier. (Murray 2014, Klasing 1998).
Mammifères
Les lapins et les rongeurs sont fréquemment utilisés pour l’alimentation en captivité des rapaces se nourrissant de mammifères. Bien que relativement dispendieux, les rats et souris de laboratoires sont des aliments populaires. Les rats et les souris élevés en captivité tendent à être plus riches en matières grasses et plus pauvres en protéine que leurs congénères sauvages (Fig 12) (Murray 2014, Chitty 2008, Crissey 1999, Douglas 1994). Pour minimiser le risque d’excès alimentaire en matière grasse, proposez des rats sub-adultes et des souris pesant approximativement 75% du poids adulte (N. Forbes, communication écrite, Sep 2015).

Figure 12. Les souris, une source nutritionnelle adéquate, sont souvent offertes pour alimenter des oiseaux de proie captifs. Toutefois, les souris élevées en laboratoires tendent à être relativement riches en matières grasses. Crédit photographique : Dr Elizabeth Daut. Cliquer sur l’image pour l’agrandir.
Oiseaux
Les poussins de un jour, les cailles du genre Coturnix, le poulet et la dinde (Forbes 2015, Murray 2014, Chitty 2008) sont des oiseaux fréquemment utilisés pour l’alimentation des rapaces dans un contexte de réhabilitation. Les poussins sont facilement disponibles et relativement peu dispendieux. Des poussins de un jour de bonne qualité contiennent des quantités adéquates de protéines ainsi que des bons niveaux de calcium et de vitamines liposolubles. Malheureusement, les poussins de un jour et les autres régimes alimentaires reposant sur la consommation d’oiseaux comportent un risque augmenté de transmission de Salmonella spp. et autres agents infectieux en comparaison avec les régimes alimentaires reposant sur la consommation de mammifères. Le sac vitellin est la source principale de calcium et de vitamine liposoluble et les poussins de un jour devraient en conséquence être offerts avec le sac vitellin intact (Chitty 2008, Bird 1976). Malheureusement, le jaune est également une source abondante de cholestérol et les poussins avec un sac vitellin intact ne devraient pas être utilisés comme source d’alimentation sur le long terme plus que deux fois par semaine (N. Forbes, communication écrite, Sep 2015).
Les pigeons et les colombes ne devraient pas être utilisés pour nourrir les rapaces dans la mesure ou plusieurs agents infectieux, incluant Trichomonas* spp., l’herpèsvirus du faucon et la tuberculose peuvent potentiellement être transmis (Forbes 2015, Murray 2014, Redig 2009, Cooper 2002).
*Note de l’Editeur: Concernant la trichomonose, certains cliniciens rapportent être en mesure de réduire ou prévenir le risque de transmission avec succès en servant des pigeons et des colombes qui ont été préalablement congelés et décongelés. A ce jour, il n’existe pas de références ayant montré que le protozoaire était effectivement tué après congélation. De plus, une étude montre que T. gallinae est très résistant aux dommages infligés par le froid et qu’il est le seul des trichomonas spp. à survivre à un épisode de congélation et de décongélation de 6 mois, y compris sans l’aide du glycérol comme protecteur (McEntegart 1954).
Il existe une étude menée par Bailey et al, montrant que la congélation pendant 24 heures de carcasses de pigeon infectées par T. gallinae inactivait les trichomonas, ce qui pourrait réduire le risque de transmission de la maladie (Bailey et al 2000). Plusieurs sources recommandent également de retirer le jabot, l’œsophage cervical et la tête des carcasses de pigeons/colombes congelées puis décongelées avant de les servir pour diminuer le risque de transmission. Toutefois, cette pratique ne peux éliminer complètement ce risque dans la mesure où les trichomonas peuvent être présents dans d’autres tissus en cas de maladie (Ford 2010, Ford et al 2009, Forbes 2008).
Poissons
Des truites entières, fraîches et sauvages sont idéales pour les oiseaux de proie consommateurs de poissons car les poissons d’élevage sont généralement beaucoup plus riches en matières grasses (Chitty 2008). Supplémentez les poissons congelés avec de la vitamine B1 car l’activation des thiaminase détruit les vitamines disponibles (Chitty 2008). Complémentez avec de la thiamine à hauteur de 30 mg/kg de poisson distribué, toutes les 24 à 48 heures (Murray 2014, Joseph 2006, Cooper 2002).
Conservation et manipulation des proies
Maintenez tous les équipements et outils de stockage de la nourriture de façon hygiénique (Chitty 2008). Les ustensiles, les planches à découper, les conteneurs alimentaires, les tables et les gants devraient être nettoyés adéquatement et désinfectés quotidiennement (Crissey 2001). Les organisations qui utilisent des proies régulièrement devraient posséder des réfrigérateurs et des congélateurs dédiés à la conservation de la viande (Fig 13) (Crissey 2001).

Figure 13. Stockez les proies dans un congélateur dédié à la conservation de la viande. Crédit photographique: Centre pour la Faune Sauvage de Virginie. Cliquez sur l’image pour l’agrandir.
Congélation des proies
Eviscérez partiellement les proies immédiatement après qu’elles aient été tuées avant de les congeler car les bactéries présentes dans le tractus gastro-intestinal sont les plus susceptibles de contaminer la viande. Laissez les autres viscères tels que le foie, les reins et le cœur en place (Chitty 2008). Congeler rapidement la carcasse pour empêcher la multiplication des bactéries (Forbes 2015), et conservez les carcasses dans un congélateur maintenu entre -30 et -18°C (–22 et 0°F) (Crissey 2001, AZA NAG). Les températures supérieures à –9°C (16°F) mais inférieure au point de congélation peuvent affecter négativement l’apparence de la nourriture et de la composition nutritionnelle (Crissey 2001). La nourriture stockée peut être conservée sur des périodes de temps prolongées (par exemple jusqu’à un an), dans un congélateur dont la température est maintenue à -23°C (–10°F) ou plus basse. Il n’existe pas d’étude émettant des recommandations concernant la durée de conservation spécifique pour chaque type de proie entière (Crissey 2001), toutefois les poissons congelés ne devrait idéalement pas être conservé plus de 4 à 6 mois (Bernard 1997).
Décongélation des proies
La congélation a tendance à léser les tissus, et rend les proies plus sensibles à une invasion bactérienne après la décongélation (Crissey 2001). Une décongélation incorrecte augmente non seulement le potentiel de prolifération bactérienne, mais également celui de perte de nutriments, de perte de goût et de peroxidation des lipides ou rancidité (Crissey 2001). NE JAMAIS décongeler de la viande à température ambiante (Crissey 2001, Bernard 1997). Utiliser de l’eau courante pour décongeler de la viande seulement en cas de situation d’urgence car cette méthode augmente les déperditions de nutriments. La méthode de choix la plus sécuritaire est de décongeler des proies sur 24-48 heures en utilisant un réfrigérateur propre réglé à 2°C–3.5°C (36°F–38°F) (Forbes 2015, Chitty 2008, Crissey 2001, AZA NAG). L’humidité relative devrait être maintenue à 85-90% dans les espaces réfrigérés (Crissey 2001). La viande fraîche ou décongelée devrait être utilisée sous 24 heures (Crissey 2001). Ne jamais décongeler, éviscérer et recongeler des proies.
Suivi du patient
Un suivi attentif du patient permettra d’ajuster la quantité de nourriture proposée à ses besoins. (Dierenfeld 2014). Evaluez le poids corporel et la note d’état corporel régulièrement et observer avec attention et minutie les pelotes et les fientes. Rappelez-vous qu’une réduction de la masse musculaire pectorale peut être attribuée à une activité diminuée malgré une alimentation adaptée.
Les fientes des rapaces ou “émeuts” sont généralement composées de fécès brun foncées à noires entourées par des urates blanches et une petite quantité d’urine claire. Les fécès peuvent être marron chez les oiseaux nourris avec des poussins de un jour (Fig 14) (Redig 2009, Joseph 2006). Les fientes peuvent être plus molles lorsque la ration alimentaire ne contient pas de matériel permettant la formation de pelote (Cooper 2002).

Figure 14. Fientes contenant une quantité relativement importante d’urine et des feces cuivrées produite par un oiseau consommant des poussins âgés de 1 jour. Crédit photographique: Dr Elizabeth Daut. Cliquer sur l’image pour l’agrandir.
Le volume, l’apparence et le temps de production des pelotes ou boulette de régurgitation varient en fonction de l’espèce, du régime alimentaire et des individus (Fig 2)(Chitty 2008). Les chouettes et les hiboux éjectent généralement une pelote par repas. Les buses et les faucons éjectent souvent une pelote tous les deux à trois repas, en fonction de l’aliment utilisé, moins souvent avec les poussins, plus souvent avec les rongeurs. Plusieurs pelotes peuvent être produite si le repas est très volumineux (Duke 1996, Duke 1976, Balgooyen 1971). Les rapaces nourris avec des souris de laboratoires blanches produisent des pelotes marron-claires, alors que les pelotes produites à partir d’oiseaux sauvages tendent à être plus sombres. Les pelotes fraîches peuvent être couvertes de mucus et occasionnellement de pigments biliaires en surface. Les pelotes normales devraient être inodores.
Une incapacité à produire une pelote peut indiquer un dysfonctionnement du tractus gastro-intestinal. La production de pelote peut se produire dans les 12-16 heures après un repas (Chitty 2008), mais cet intervalle peut néanmoins varier largement suivant les espèces, l’état de santé et le repas. Une buse à queue rousse en santé peut n’expulser une pelote qu’après 24 à 48 heures suite à un gros repas. (D. McRuer, communication écrite, Dec 2015).
L’eau
Les oiseaux sauvages puisent la plupart de leur besoin hydrique quotidiens dans leurs aliments. Toutefois, les oiseaux en captivité devraient toujours avoir un accès à de l’eau de boisson (Forbes 2015, Chitty 2008). Considérez de retirer le bol d’eau avant de faire voler un oiseau pour que les plumes de soient détrempées (Chitty 2008). Assurez-vous que le bol d’eau puisse être facilement désinfecté. (Forbes 2015).
Résumé
Le tube digestif des rapaces est un système assez simple associant un ventricule faiblement développé ainsi que des caeca et un gros intestin relativement sous développés. Néanmoins, le tractus gastro-intestinal fonctionnel des rapaces possède une demande métabolique très élevée, nécessitant une grande quantité d’énergie et d’hydratation, en relation avec le phénomène de compaction des matériaux indigestibles également appelé pelote. La prise en charge des rapaces faibles, ou émaciés comprend la minimisation du stress, l’apport de chaleur supplémentaire, une fluidothérapie ainsi qu’une supplémentation en thiamine et autre vitamines du groupe B. Le soutien nutritionnel ne devrait pas être débuté tant que le patient n’est pas réchauffé et que les carences hydro-électrolytiques n’ont pas été corrigées. Les tests diagnostiques initiaux peuvent également être différés si le patient est extrêmement débilité. Les rapaces très faibles sont souvent alimentés à la sonde au départ. Lorsqu’une transition alimentaire précautionneuse est réalisée vers des aliments solides, les proies les plus fréquemment proposées au patient sont les lapins, les rongeurs comme les souris ou les rats, les poussins de un jour et les cailles du genre Coturnix disponibles dans le commerce.
**S’enregistrer pour consulter les références**
Références
Références
AZA Nutrition Advisory Group. NAG Carcass Feeding Statement. NAG website. [En ligne] http://nagonline.net/guidelines-aza-institutions/nag-carcass-feeding-statement/. Page consultée le 24 Juin 2015.
Balgooyen TG. Pellet regurgitation by captive sparrow hawks (Falco sparverius). Condor 73(3):382-385, 1971.
Bailey TC, Samour JH, Bailey TA, et al. Trichomonas sp. and falcon health in the United Arab Emirates. In: Lumeij JT, Remple JD, Redig PT, et al. (eds). Raptor Biomedicine III including Bibliography of Diseases of Birds of Prey, 3rd ed. Lake Worth, FL: Zoological Education Network; 2000: 53-57.
Barton NW, Houston DC. A comparison of digestive efficiency in birds of prey. Ibis 135 (4):363–371, 1993.
Bernard JB, Allen ME. 1997. Feeding captive piscivorous animals: nutritional aspects of fish as food. In Nutrition Advisory Group Handbook Fact Sheet 005. 1997. [En ligne] http://nagonline.net/810/feeding-captive-piscivorous-animals-nutritional-aspects-fish-food/. Page consultée le 24 Juin 2015.
Bird DM, Ho SK. Nutritive values of whole-animal diets for captive birds of prey. Raptor Res 10(2):45–49, 1976.
Chitty J. Raptors: nutrition. In: Chitty J, Lierz M (eds). BSAVA Manual of Raptors, Pigeons and Passerine Birds. Gloucester, UK: BSAVA; 2008.
Cooper JE. Nutritional diseases, including poisoning, in captive birds. In: Birds of prey: health and disease. 3rd edition. Oxford: Blackwell Science Ltd; 2002: 143–62.
Crissey SD, Slifka KA, Shumway P, Spencer SB. Handling Frozen/Thawed Meat and Prey Items Fed to Captive Exotic Animals. USDA Animal and Plant Inspection Service. National Technical Information Service, 5285 Port Royal Road, Springfield, NA 22161. 2001. [En ligne] http://www.aphis.usda.gov/animal_welfare/downloads/big_cat/handlemeat.pdf. Page consultée le 24 Juin 2015.
Crissey SD, Slifka KA, Lintzenich BA. Whole body cholesterol, fat, and fatty acid concentrations of mice (Musdomesticus) used as a food source. J Zoo Wildl Med 30(2):222-227, 1999.
Denbow DM. Gastrointestinal anatomy and physiology. In: Whittow GC (ed).
Sturkie’s Avian Physiology. 5th ed. San Diego (CA): Academic Press; 2000: 299–325.
Dierenfeld ES, Alcorn HL, Jacobsen KL. Nutrient composition of whole vertebrate prey (excluding fish) fed in zoos. Nat AgricLibr Z7994, Z65, p. 20. Available at http://nagonline.net/3112/nutrient-composition-of-whole-vertebrate-prey-excluding-fish-fed-in-zoos/. Accessed July 9, 2015.
Dobbs J. 1983. Glucose utilization in an avian carnivore, the red tailed hawk, as measured by glucose tolerance tests. PhD thesis. Avian Sci Dept. UC Davis, CA.
Douglas TC, Pennino M, Dierenfeld ES. Vitamins E and A, and proximate composition of whole mice and rats used as feed. Comp BiochemPhysiol 107(2):419-424, 1994.
Duke GE. Gastrointestinal physiology and nutrition in wild birds. ProcNutrSoc 56:1049-1056, 1997.
Duke GE, Evanson OA, Jegers A. Meal to pellet intervals in 14 species of captive raptors. Comp BiochemPhysiol 53(1):1–6, 1976.
Duke GE, Tereick AL, Reynhout JK, et al. Variability among individual American kestrels (Falco sparverius) in parts of day-old chicks eaten, pellet size, and pellet egestion frequency. J Raptor Res 30(4):213-218, 1996.
Forbes NA. Raptor nutrition. Proc International Conference on avian herpetological and exotic mammal medicine. 2015;33-36.
Forbes NA. Raptors: Parasitic disease. In: Chitty J, Lierz, M (eds). BSAVA Manual of Raptors, Pigeons and Passerine Birds. 2nd ed. Gloucester (MA): British Small Animal Veterinary Association; 2008: 202-211.
Ford S. Raptor gastroenterology. J Exot Pet Med 19(2):140-150, 2010.
Ford S, Chitty J, Jones MP. Raptor Medicine Master Class. ProcAnnuConfAssoc Avian Vet. 2009;143-162.
Garcia-Rodriguez T, Ferrer M, Carrillo JC, et al. Metabolic responses of Buteo buteo to long-term fasting and refeeding. Comp BiochemPhysiol 87A(2):381–386, 1987.
Handrich Y, Nicholas L, Le Maho Y. Winter starvation in captive common barn owls: physiological states and reversible limits. Auk 110(3):458–469, 1993.
Hayes G, Benedicenti L, Mathews K. Retrospective cohort study on the incidence of acute kidney injury and death following hydroxyethyl starch (HES 10% 250/0.5/5:1) administration in dogs (2007-2010). J Vet EmergCrit Care 26(1):35-40, 2016.
Huynh M, Sabater M, Brandão J, Forbes NA. Use of an esophagostomy tube as a method of nutritional management in raptors: a case series. J Avian Med Surg 28(1):24-30, 2014.
Joseph V. Raptor medicine: an approach to wild, falconry, and educational birds of prey. Vet Clin North Am ExotAnimPract 9(2):321-345, 2006.
Kirkwood JK. Maintenance energy requirements and rate of loss during starvation in birds of prey. In: Cooper JE, Greenwood AG (eds). Recent Advances in Raptor Diseases. Chiron Publ. Keighly. UK; 1981
Klasing KC. Comparative Avian Nutrition. New York: CABI Publishing; 1998.
Kubiak M, Forbes N. Effects of diet on total calcium, vitamin D and parathyroid hormone in falcons. Vet Rec 171(20):504, 2012.
Labato, MA. 1992. Nutritional management of the critical care patient. In Kirk, RW, Bonagura, JD (eds). Current Veterinary Therapy XI. WB Saunders Co: 117-124.
McCray S, Walker S, Parrish, CR. Much ado about refeeding. Practical Gastroenterology 5: 26-44, 2005.
McEntegart MG. The maintenance of stock strains of trichomonads by freezing. J Hyg 52(4):545-550, 1954.
McLelland J. Digestive system. In: King AS, McLelland J, editors. Form and Function in Birds, vol. 1. London: Academic Press; 1979: 69–181.
Murray M. Raptor gastroenterology. Vet Clin North Am ExotAnimPract 17(2):211-234, 2014.
O’Donnell JA, Garbett R, Morzenti A. Normal fasting plasma glucose levels in some birds of prey. J Wildl Dis 14(4):479-481 1978.
Redig PT, Cruz-Martinez L. Raptors. In: Tully TN, Dorrestein GM, Jones AK (eds).Handbook of Avian Medicine, 2nd ed. New York: Saunders Elsevier;2009: 209-242.
Rodríguez A, Negro JJ, Figuerola J. Sources of variation for nutritional condition indices of the plasma of migratory lesser kestrels in the breeding grounds. Comp BiochemPhysiol A MolIntegrPhsyiol 160(4):453-460, 2011
Shapiro CJ, Weathers WW. Metabolic and behavioral responses of American kestrels to food deprivation. Comp BiochemPhysiol 68A(1):111–114, 1981.
Lectures complémentaires
Barton NW, Houston DC. A comparison of digestive efficiency in birds of prey. Ibis 135(4):363-371, 1993.
Braun EJ, Sweazea KL. Glucose regulation in birds. Comp BiochemPhysiol 151(1):1–9, 2008.
Chaplin SB. Effect of cecectomy on water and nutrient absorption of birds. J ExpZoolSuppl 3:81-86, 1989.
Denbow DM. Gastrointestinal anatomy and physiology. In: Whittow GC (ed). Sturkie’s Avian Physiology, 5th ed. San Diego (CA): Academic Press; 2000: 299–325.
Duke GE, Bird JE, Daniels KA, et al. Food metabolizability and water balance in intact and cecectomized great-horned owls. Comp BiochemPhysiol 68(2):237-240, 1981.
Duke GE, Fuller MR, Huberty BJ. The influence of hunger on meal to pellet intervals in barred owls. Comp BiochemPhysiol 66(2):203-207, 1980.
Facon C, Beaufrere H, Gaborit C, et al. Cluster of atherosclerosis in a captive population of black kites (Milvusmigrans subsp.) in France and effect of nutrition on the plasma lipid profile. Avian Dis 58(1):176-182, 2014.
Fuller MR, Duke GE, Eskedahl DL. Regulation of pellet egestion: the influence of feeding time and soundproof conditions on meal to pellet intervals of red-tailed hawks. Comp BiochemPhysiol 62(2):433-438, 1979.
King AS, McLelland J. Digestive system. In: Birds: their structure and function. 2nd ed. London: BailliereTindall; 1984: 84–109.
Klaphake E, Clancy J. 2005. Raptor Gastroenterology. Vet Clin North Am ExotAnimPract 8(2):307-327, 2005.
Migliorini RH, Linder C, Moura JL, et al. Gluconeogenesis in a carnivorous bird (black vulture). Am J Physiol 225:1389-1392, 1973.
Myers MR, Klasing KC. Low glucokinase activity and high rates of gluconeogenesis contribute to hyperglycemia in barn owls (Tyto alba) after a glucose challenge. J Nutr 129(10):1896-1904, 1999.
Orosz SE. 2008. Critical Care Nutrition for Birds. ProcAnnuConf MASSAV. Williamsburg, VA: 208-214.
Quesenberry KE, Maudlin G, Hillyer EV. 1991. Review of methods of nutritional support in hospitalized birds. ProcAnnuConf European Assoc Avian Vet. Vienna: 243-254.
Tabaka CS, Ullrey DE, Sikarskie JG, et al. Diet, cast composition, and energy and nutrient intake of red-tailed hawks (Buteojamaicensis), great horned owls (Bubo virginianus), and turkey vultures (Cathartes aura). J Zoo Wildl Med 27(2):187-196, 1996.
Veiga JA, Roselino ES, Migliorini RH. Fasting, adrenalectomy, and gluconeogenesis in the chicken and a carnivorous bird. Am J Physiol 234(3):115-121, 1978.
